Будова електронних оболонок атомів хімічних елементів. Стан електронів у атомі. Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елем
8 клас
Урок № 9
Тема: Будова електронних оболонок атомів хімічних елементів. Стан електронів у атомі. Електронні орбіталі. Енергетичні рівні та підрівні; їх заповнення електронами в атомах хімічних елементів № 1-20.
Мета:
- освітня: ознайомитися з будовою електронною оболонок атомів хімічних елементів, пояснити поняття «орбіталь», «енергетичний рівень», «енергетичний підрівень»;
- розвивальна: розвивати пізнавальну активність учнів, вдосконалювати навички виконання самостійних робіт; сформувати вміння учнів характеризувати хімічні властивості елементів за їх місцем в періодичній системі;
- виховна: виховувати старанність, допитливість, інтерес до предмету, ініціативність.
Матеріали та обладнання: Періодична система хімічних елементів Д.І. Менделєєва, робочі зошити, ручки, підручники, картки.
Очікувані результати: На кінець уроку учні вміють:
· правильно вживати терміни з даної теми;
· вирізняти потрібну інформацію при самостійній роботі з даної теми;
· користуватися Пс більш глибше з урахуванням електронних конфігурацій;
· чітко та обґрунтовано висловлювати свою думку наприкінці уроку.
Ключові компетентності: спілкування державною мовою (формулювати відповідь на поставлене запитання, робити висновки), Математична компетентність (створювати просторову уяву для складання будови атома; тлумачити схеми), соціальна та громадянська компетентності оцінювати й шанувати внесок видатних українців, зокрема вчених-хіміків, у суспільний розвиток.
Тип уроку: засвоєння нових знань.
ХІД УРОКУ
Організаційний етап уроку
Вчитель вітається з учнями, записує відсутніх до журналу.
І. Актуалізація почуттєвого досвіду й опорних знань учнів
Індивідуальні завдання: (3 хв.) – 3 учні .
Розрахувати кількість протонів, електронів та нейтронів в атомах
елементів з порядковими номерами 7, 20, 29.
ІІ. Мотивація навчальної діяльності учнів
Електрон є дивовижною частинкою. Стан електрона в атомі можна
описати з точки зору законів мікросвіту.
Електрон – це мікрочастинка, яка має подвійну природу. З одного
боку електрон має властивості частинки, а з іншого – властивості хвилі.
Сьогодні на уроці ви дізнаєтеся більше про властивості електрона,
ми опишемо стан електрона в атомі; з’ясуємо суть понять: «орбіталь»,
«енергетичний рівень», «енергетичний підрівень».
ІІІ. Повідомлення теми, мети уроку
Вчитель оголошує тему, мету уроку записує тему на дошці.
ІV. Сприйняття й первинне усвідомлення учнями нового матеріалу
Властивості електрона
Уявлення про будову речовини, у тому числі й про будову атома, пройшли складний шлях розвитку. Першим основоположним досягненням у вивченні внутрішньої будови речовини було створення моделі атома англійським фізиком Резерфордом (1911 р.). Ви вже знаєте, що атом за Резерфордом, складається з ядра й електронів, які рухаються навколо нього.
На той час електрони вважалися частинками. Але згодом стало відомо, що електрон виявляє властивості і частинки, і хвилі. Крім цього, ще треба враховувати і те, що світ атома – це мікросвіт, де діють інші закони, не такі, як ми звикли в умовах макросвіту.
Електрон – елементарна негативно заряджена частинка, яка входить до складу атома.
Поняття «орбіталь»
Рух електрона в атомі неможливо описати певною траєкторією (неперервною лінією, яку описує матеріальна точка чи тіло під час руху). Розглядати можна лише деякий об’єм простору, в якому перебуває електрон (принцип невизначеності Гейзенберга). Він заповнює цей простір у формі хвилі, яку можна уявити як електронну хмару.
Атомна орбіталь – це простір, де найбільш імовірне перебування електрона.
Енергетичний рівень – формують електрони з однаковим або майже однаковим запасом енергії.
Крім руху в просторі поблизу ядра, електрон має свій власний рух – спін. Спрощено його можна уявити як рух навколо власної осі.
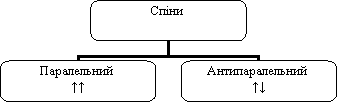
Спін електрона – стан електрона в атомі.
Форми руху електронів
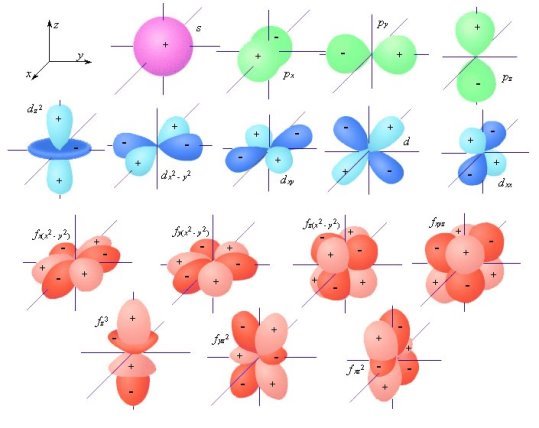
Будова енергетичних рівнів атома
|
Рівень відповідає № періоду |
Число орбіталей |
Типи орбіталей на рівні |
Максимальна кількість електронів на рівні |
|
n |
n2 |
s, p,d,f,g,h,i |
|
|
1 |
1 |
|
2 |
|
2 |
4 |
|
6 |
|
3 |
9 |
|
10 |
|
4 |
16 |
|
14 |
|
5 |
25 |
|
18 |
|
6 |
36 |
|
22 |
|
7 |
49 |
|
26 |
V. Осмислення об'єктивних зв'язків і відносин у досліджуваному матеріалі
Заповнення орбіталей
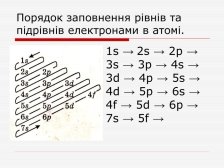
Вчитель роздає учням таблиці.
VІ. Узагальнення й систематизація знань.
Тестування.
1) р-орбіталі мають форму:
а) кулі;
б) гантелі;
в) еліпса.
2) енергію орбіталі визначає:
а) головне квантове число;
б) орбітальне квантове число;
в) магнітне квантове число.
3) сукупність всіх орбіталей з одним і тим самим значенням n називають:
а) енергетичний підрівень;
б) енергетичний рівень;
в) енергетична підоболонка.
VІІ. Підсумок уроку
Гра «Мікрофон»
Учням вчитель видає мікрофон, в який вони доповідають, що запам’ятали.
VІІІ. Домашнє завдання
4-9 балів: опрацювати матеріал § 7, ст. 38-43.
10-12 балів: доповідь «квантове число».


про публікацію авторської розробки
Додати розробку
