Електроліти й неелектроліти Електролітична дисоціація.
Про матеріал
Розкрити суть процесів, що відбуваються в розчинах, ознайомити з поняттям „електролітична дисоціація», залежність електропровідності розчинів від виду хімічного зв'язку й типу кристалічної гратки речовини, формувати вміння знаходити відповіді на проблемні питання за допомогою досліджень, розвивати компетентність інформаційну, продуктивної творчої діяльності, саморозвитку й самоосвіти.
Тема
Електроліти й неелектроліти Електролітична дисоціація.
Мета: ознайомити учнів з класифікацією речовин за їхньою здатністю проводити електричний струм у водному розчині або в розплаві на електроліти та неелектроліти; сформувати поняття «електроліти та неелектроліти»; розкрити суть процесу електролітичної дисоціації, залежність електропровідності розчинів і розплавів речовин від їхньої будови; пояснити роль води в процесі дисоціації; ознайомити з теорією електролітичної дисоціації С. Арреніуса; розвивати вміння спостерігати і робити висновки.
Очікувані результати: учні мають знати механізм електролітичної дисоціації; учні мають встановлювати залежність електропровідності розчинів від виду хімічного зв’язку й типу кристалічних ґраток розчиненої речовини; учні мають уміти записувати рівняння електролітичної дисоціації.
Тип уроку: урок - дослідження
Обладнання: таблиця розчинності, прилад для визначення електропровідності розчинів, Відео «Електролітична дисоціація речовин.» ,зразок упаковки «Фізіологічний розчин», книга «Домашнее консервирование»
І. Організаційний етап
Актуалізація опорних знань
Сьогоні продовжуємо вивчати тему «Розчини». Звернемо увагу на екран!
Девіз нашого уроку:

Вчитель. Але перед тим, як вивчити нову тему ми звами розв’яжемо декілька цікавих задач
Вчитель: Щедре літо дарує нам багато фруктів та овочів. І ваші мами, бабусі роблять заготовки на зиму шляхом консервуванням. А яку допомогу можете ви надати своїм рідним, які займаються консервуванням? Увага на екран! Звісно
Розрахунками. Для цього розв’яжемо задачу.

Задача 1.
Для приготування компоту з вишень плоди в банках заливають гарячим цукровим сиропом 50%-ної концентрації (масова частка розчиненого цукру становить 50%). Скільки цукру і води слід узяти для приготування 8 кг сиропу?
Цю задачу можна розв’язати і усно. Подивіться уважно на данні задачі!
Перевірка виконання.
Вчитель: Сподіваюся, що ці рецепти та розрахунки до них стануть у нагоді та допоможуть вам у майбутньому зберегти частину овочів для зими.
Вчитель: Не тільки харчова промисловість потребує подібних розрахунків. Великий попит на фахівців у хімічних лабораторіях: на заводах, комбінатах, лікарнях, аптеках тощо. Бувають травмування людей з крововтратами. Зараз на уроках біології ви вивчаєте тему «Кров та кровообіг», пригадайте, що лікарі роблять для ліквідації негативних наслідків втрати крові. Правильно, вони вводять фізіологічний розчин. Він являє собою розчин хлориду натрію в дистильованій воді, але масова частка розчиненої речовини мала – всього 0,9%. Але слід пам’ятати, якщо від зайвої ложечки цукру не буде нічого небезпеч-ного для життя, то збільшення концентрації кухонної солі, як і зменшення, може призвес-ти до загибелі людини. Тому потрібна ретельна увага при виконанні розрахунків та при-готування фізіологічного розчину.
Задача 4.
Ви – лаборант у великій лікарні і саме перед вами постало завдання у необхідності приготування фізіологічного розчину масою А. Скільки треба взяти натрій хлориду (маса солі В та води (маса води Г) для приготування фізіологічного розчину визна-ченої маси?
|
Варіант |
А |
Б |
В |
Г |
|
І |
12 кг |
0,9% |
|
|
|
ІІ |
700 г |
0,9% |
|
|
|
ІІІ |
65 кг |
0,9% |
|
|
Перевірка виконання завдання.
ІІ. Мотивація навчальної діяльності. Повідомлення теми, мети і завдань уроку
На межі XVIII I XIX століть, коли для дослідження властивостей речовин почали застосовувати електричний струм, звернули увагу на те, що одні речовини, перебуваючи у водному розчині, проводять електричний струм, а інші його не проводять. Тому сьогоднішня тема допоможе нам у цьому розібратись.
Мозковий штурм
- Наведіть відомі вам провідники електричного струму. (Метали, сплави металів, водопровідна вода, розчин солі.)
- Які необхідні умови існування електричного струму в середовищі? (Наявність джерела струму і вільних носіїв електричного заряду.)
- Які види хімічного зв'язку ви знаєте?
- Чим відрізняється ковалентний полярний зв'язок від ковалентного неполярного?
- Наведіть приклади речовин із йонним типом зв'язку.
- Чому вода є добрим розчинником?
- Що таке катіони? Аніони?
ІІІ. Вивчення нового матеріалу
Оголошення теми уроку
Всі водні розчини, розплави, щоб їх простіше вчити
Вчені примудрилися на групи розділити
Одних, щоб довго не мудрити
Вони назвали електроліти.
А інших, щоб скінчили нити
Назвали неелектроліти.
А Сванте Ареніус, що в Швеції проживав
Теорію електролітичної дисоціації заснував.
Дослідження речовин на електропровідність

Перевіремо на електропровідність дистильовану воду і водопровідну. Занурюємо електроди у склянку з дистильованою водою – лампочка не горить, занурюємо у склянку з водопровідною - лампочка горить. Чому? (Водопровідна вода містить розчинені солі.)
З'ясуємо електропровідність сухої кухонної солі і її розчину. Сухі електроди помістимо в сухий Натрій хлорид – лампочка не світить, зануримо електроди у розчин солі – лампочка засвітиться. Чому?
( В процес розчинення утворились носії електричного заряду.)
Вправа «Мікрофон».
В інструкціях до побутових приладів у розділі «Правила безпеки» завжди пишуть «Берегти від води». Спробуйте пояснити чому. (Тому, що вода проводить електричний струм.)
— Чи всі речовини проводять електричний струм? Як називаються речовини, що проводять електричний струм?
-Чи всі речовини здатна так змінювати вода ? Проведемо аналогічні дослідження із цукром, хлоридною кислотою, натрій гідроксидом. Результати досліджень записують у таблицю.
|
Назва речовини |
Електропровідність |
Тип хімічного зв’язку |
|
|
|
чистої речовини |
її розчину |
|
|
Вода (дистильована) н2о |
- |
- |
Ковалентний полярний |
|
Натрій хлорид |
- |
+ |
Йонний |
|
Сахароза С12Н22О11 |
- |
- |
Ковалентний слабо полярний |
|
Натрій гідроксид |
- |
+ |
Йонний |
|
Хлоридна кислота |
- |
+ |
Ковалентний сильно полярний |
Учні роблять висновок, про те, що електричний струм проводять водні розчини речовин із йонним або ковалентним сильно полярним типом хімічного зв’язку.
Розповідь учителя
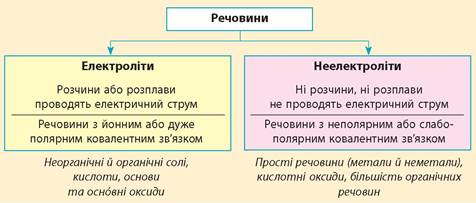
Електроліти – речовини, розчини або розплави яких проводять електричний струм. (Кислоти, солі,основи.)
Неелектроліти - речовини, розчини або розплави яких не проводять електричний струм. (Цукор, жир, крохмаль, спирт, ацетон.)
Щоб зрозуміти причину електропровідності речовин після розчинення у воді необхідно пригадати особливості будови молекули води . (Диполь, з ковалентним полярним зв'язком.)
Схема 4. Класифікація речовин на електроліти та неелектроліти
![]()
Дослідження процесу електролітичної дисоціації
Відеофільм «Електролітична дисоціація речовин»
https://www.youtube.com › watch
Демонстрація на мультимедійній дошці процесу електролітичної дисоціації кухонної солі, речовини з йонним типом зв'язку.
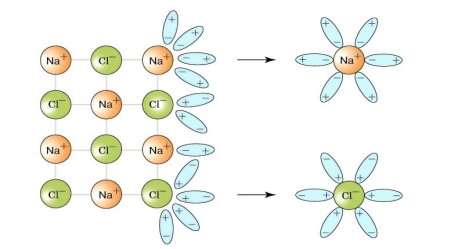
NaCl↔Na+ + Cl-
Демонстрація на мультимедійній дошці процесу електролітичної дисоціації хлоридної кислоти, речовини з ковалентним полярним типом зв'язку.
HCl↔ Н+ + Cl-

Учні за допомогою вчителя формулюють визначення:
Електролітична дисоціація у водних розчинах – це процес розпаду електроліту на йони під впливом полярних молекул води.
Розповідь учителя
Основні положення теорії електролітичної дисоціації сформулював шведський учений Сванте Август Арреніус у 1887 році, за що у 1901 році отримав Нобелівську премію з хімії. Повідомлення-презентація
Основні положення ТЕД
- Електролітична дисоціація відбувається під впливом полярних молекул розчинника.
- Процес дисоціації є оборотним
- При розчиненні у воді молекули електролітів дисоціюють на позитивно і негативно заряджені йони: катіони і аніони.
- Йони у водному розчині перебувають у хаотичному безперервному русі. Якщо у розчин електроліту занурити електроди і прикласти до них електричну напругу, то іони набудуть направленого руху: позитивно заряджені іони переміщуватимуться у напрямі до катода (негативно зарядженого електрода), а негативно заряджені іони у напрямку анода (позитивно зарядженого електрода).
- Гра «Третій — зайвий».
Вибрати «зайве» поняття, пояснити свій вибір.
1. Сірка, бром, кальцій хлорид, вуглець.
2. Вуглекислий газ, водень, метан, оцет.
3. Цукор, крейда, натрій сульфат, калій хлорид.
4. Вода, сульфатна кислота, натрій гідроксид, калій силікат.
5. Алюміній нітрат, магній хлорид, ортофосфатна кислота, натрій карбонат.
IV. Підбиття підсумків уроку
Вчитель: ви сьогодні добре попрацювали на уроці, виконали усе, що було заплановано. Я вдячний за вашу роботу,активність, співпрацю. Сподіваюся, що той об’єм знань, який ви отримали, допоможе і вам, можливо, під час вибору майбутньої професії (Коментуються виставлені оцінки за роботу кожного учня).
V. Домашнє завдання: Прочитати параграф. Виконати завдання:
1) Проаналізуйте зміст етикеток на пляшках різних мінеральних вод. Розподіліть зазначені на них йони у відповідні колонки таблиці:
|
Катіони |
Аніони |
|
|
|
2) Поясніть, чи зміниться електропровідність води, якщо крізь неї пропускати:
а) азот; б) Сульфур (VІ) оксид; в) кисень; г) Гідроген бромід.
3) У кристалізатор з водою пінцетом обережно помістили невеликий шматочок натрію. Після закінчення хімічної реакції у добутий розчин
занурили електроди приладу для вимірювання електропровідності. Опишіть перебіг реакції та запишіть її хімічне рівняння. Чи проводитиме розчин одного з її продуктів (якого саме?) електричний струм? Поясніть,
чому.
Куяльницька ЗОШ І-ІІІ ступенів
Конкурс «Вчитель року»
Урок-дослідження
Електроліти й неелектроліти. Електролітична дисоціація

Підготувала
вчитель хімії
Вдовиченко Т.М.


про публікацію авторської розробки
Додати розробку
