Конспект уроку-Хімічні властивості спиртів
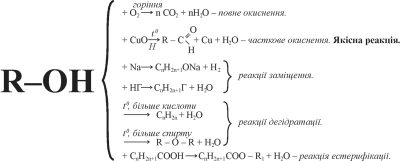
Хімічні властивості спиртів
Спирти виявляють високу реакційну здатність завдяки наявності в їхніх молекулах функціональної гідроксильної групи ОН. Спирти є нейтральними речовинами й не дисоціюють на йони.
1. Горіння спиртів
При підпалюванні спирт горить світлим полум’ям із виділенням великої кількості теплоти. Під час горіння виділяється вуглекислий газ й вода:
C2H5OH + 3O2 → 2CO2 + 3H2O.
2. Реакція окиснення
Якщо в спирт занурити розжарену мідну спіраль, покриту чорним нальотом купрум (ΙΙ) оксиду, то спіраль стане блискучою, з’явиться специфічний запах альдегіду.
Цю реакцію використовують для якісного визначення спиртів.![]()
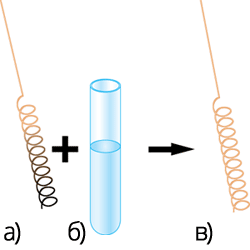
а) розжарена мідна спіраль; б) спирт; в) відновлена спіраль.
3. Взаємодія спирту з лужними металами
При дії на спирти лужних металів відбувається заміщення Гідрогену гідроксильної групи на атом металу. При цьому утворюються алкоголяти. Алкоголяти, утворені метиловим спиртом, називають метилатами, етиловим спиртом – етилатами:
2C2H5OH (етанол) + 2Na → 2C2H5ONa (натрій етилат) + H2.
Спирти, подібно до води, бурхливо взаємодіють з металічним натрієм. З лугами спирти за звичайних умов алкоголятів не утворюють.
В суху пробірку поміщають невеликий шматочок металічного натрію (розміром з горошину), очищеного й просушеного фільтрувальним папером та доливають туди 2-3 мл спирту. До пробірки приєднують трубку з відтягнутим кінцем й підпалюють газ, що виділяється. Газ горить, отже це – водень.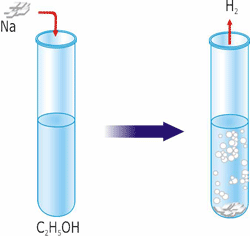
Коли реакція закінчиться, білу масу виливають в порцелянову чашку й випарюють її на водяній бані до одержання білого порошку – натрій етилату. Реакція з натрієм дає привід зарахувати спирт до класу кислот. Але спирти не забарвлюють лакмус у червоний колір, практично не взаємодіють з розчинами лугів, тому спирти не відносяться до кислот.
4. Взаємодія спирту із галогеноводнями
У присутності водовіднімаючого засобу, такого як концентрована сульфатна кислота, спирти реагують із галогеноводневими кислотами з утворенням галагенопохідних насичених вуглеводнів. На відміну від попередньої реакції, при взаємодії спиртів з галогеноводнями в процесі бере участь ОН–група повністю:
C2H5OH (етанол) + HCl → C2H5Cl (хлоретан) + H2O.
5. Дегідратація спиртів
У присутності водовіднімаючого засобу (концентрована сульфатна кислота, цинк хлориду) й підвищеної температури від молекул спиртів відщеплюється вода. Процес дегідратації може відбуватися двома різними шляхами, залежно від умов:
а) якщо дегідратація відбувається при нагріванні спирту (до 140°С) з достатньою кількістю концентрованої сульфатної кислоти, то відбувається утворення ненасиченого вуглеводню:
C2H5OH (етанол) ![]() CH2 = CH2 (етилен) + H2O;
CH2 = CH2 (етилен) + H2O;
б) якщо дегідратація відбувається за вищої температури при надлишку спирту, молекула води відщеплюється від двох молекул спирту, внаслідок чого утворюється етер:
2C2H5OH (етанол) ![]() C2H5 – O – C2H5 (діетиловий етер) + H2O
C2H5 – O – C2H5 (діетиловий етер) + H2O
Загальна формула етерів R-O-R
У промисловості діетиловий етер одержують, пропускаючи пари спирту над алюміній оксидом при 250°С.
Етери – органічні речовини, молекули яких складаються з вуглеводневих радикалів, сполучених через атом Оксигену. Загальна формула етерів R–O–R. Радикали можуть бути однаковими (при взаємодії молекул одного спирту) або різними (при взаємодії молекул різних спиртів):
CH3OH (метанол) + C2H5OH (етанол) ![]()
CH3 – O – C2H5 (метилетиловий етер) + H2O.
Загальна формула еcтерів R-COO-R
6. Взаємодія спиртів з кислотами
Спирти реагують з органічними кислотами з утворенням естерів:
CH3 – COOH (оцтова кислота) + HO – C2H5 (етиловий спирт) →
CH3 – COO – C2H5 (оцтово–етиловий естер) + H2O.
Запишіть коротку схему у зошит
Схема . Хімічні властивості спиртів
Підсумок:
- Спирти є нейтральними речовинами й не дисоціюють на йони.
- При дії на спирти лужних металів відбувається заміщення атома Гідрогену гідроксильної групи на атом металічного елемента.
- При взаємодії спиртів з концентрованими галогеноводневими кислотами утворюються галогенопохідні вуглеводнів.
- Якісною реакцією на спирти є їх взаємодія з розжареним CuO – мідь відновлюється.
- Спирти піддаються дегідруванню й дегідратації.
Дайте письмові відповіді на запитання
- Чи можна віднести спирти до кислот або основ? Чому?
- Про які властивості (кислотні чи основні) свідчить можливість взаємодії спиртів з лужними металами?
- Про які властивості (кислотні чи основні) свідчить можливість взаємодії спиртів з галогеноводнями?
- Яка реакція є якісною на спирти? Чому?
- Що таке реакція дегідратації?
- Які продукти можуть утворитися під час дегідратації спиртів? Від чого це залежить?
Завдання для самоконтролю
■1. З якими з перерахованих нижче речовин буде взаємодіяти метанол: водень, вода, хлор, бромоводень, кисень, калій, оцтова кислота СН3СООН? Запишіть рівняння можливих реакцій.
2. Який об’єм повітря необхідний для спалювання 1 л метанолу (ρ = 0,80 г/см3)?
▲3. Закінчіть рівняння реакції, вкажіть тип реакції:
C3H7OH + O2 → CO2 + H2O.
4. Закінчіть рівняння реакцій:
CH3OH + K →
CH3OH + O2 →
CH3OH + HBr →
CH3OH + CuO →
C2H5OH ![]()
2CH3OH ![]()
5. Скільки літрів кисню необхідно для спалювання етанолу масою 23 г?
6. Виведіть формулу насиченого одноатомного спирту при взаємодії якого масою 7,4 г з металічним натрієм добуто водень об’ємом 1,12 л.


про публікацію авторської розробки
Додати розробку