Презентація "Амфотерні оксиди і гідроксиди











![Лабораторний дослід одержання і властивості амфотерного гідроксид ZnSO4 + 2NaOH= Na 2 SO4 +Zn(OH)2↓ Zn(OН)2 + 2HCl= 2H2O + ZnCl2 Zn(OН)2 + 2NaOH = Na 2 [Zn(OH) 4] Тетрагідроксоцинкат натрію ( комплексна сіль) Лабораторний дослід одержання і властивості амфотерного гідроксид ZnSO4 + 2NaOH= Na 2 SO4 +Zn(OH)2↓ Zn(OН)2 + 2HCl= 2H2O + ZnCl2 Zn(OН)2 + 2NaOH = Na 2 [Zn(OH) 4] Тетрагідроксоцинкат натрію ( комплексна сіль)](/uploads/files/199937/361348/414948_images/13.jpg)



Земноводні Дитя сонця, зимою його не зустріти. Не дуже красива, але дуже важлива в природі тварина. Якщо весною ти почув її голос, значить, буде тепло чи піде дощ. Живе в двох середовищах існування живих організмів. Назва класу цієї тварини отримав літак, який приземляється на воду, і машини високої прохідності. Ця підказка найлегша: консумент 2-го порядку, який з`їв консумент 1 –го порядку (зелененького кольору).
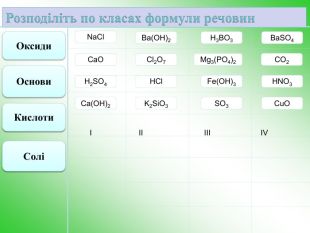
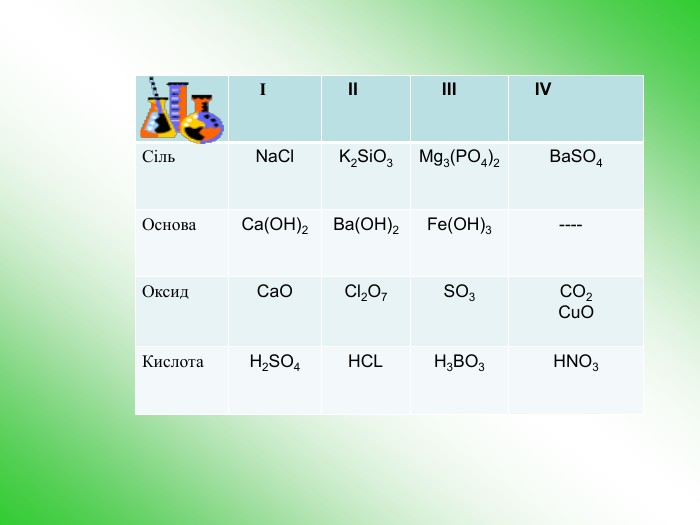
Як нерозчинна основа розкладається при нагріванні Як основи реагують з кислотами 1 Zn H O H O Cl H Cl H + = ZnCl2 + 2H2O гидроксид цинка соляная кислота хлорид цинка Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Як основи реагують з кислотними оксидами 2 Zn(OH)2 + SO3 = ZnSO4 + H2O сульфат цинка гидроксид цинка 3 Zn(OH)2 + 2NaOH = Na2ZnO2 + 2H2O Zn H O H O O H Na Na O H = + 2H2O гидроксид цинка гироксид натрия цинкат натрия Zn Na O Na O Як кислоти реагують з лугами: Як кислоти реагують з основними оксидами 4 t Zn(OH)2 + СаО = СаZnO2 + H2O гидроксид цинка цинкат кальция t Zn(OH)2 = ZnO + H2O гідроксид цинку 5


про публікацію авторської розробки
Додати розробку