Презентація до уроку хімії: "Розчин та його компоненти. Вода як розчинник. Розчинення як фізико-хімічний процес. Кристалогідрати"
Презентація для учнів 9 класу до уроку хімії: "Розчин та його компоненти. Вода як розчинник. Розчинення як фізико-хімічний процес. Кристалогідрати". Мета: сформувати поняття про склад розчинів; ознайомити з властивостями води як універсального розчинника; розвивати знання про хімічний зв'язок і будову речовини на прикладі будови молекули води й поняття про водневий зв'язок; дати уявлення про теплові явища, що супроводжують розчинення речовин, фізико-хімічну суть процесу.





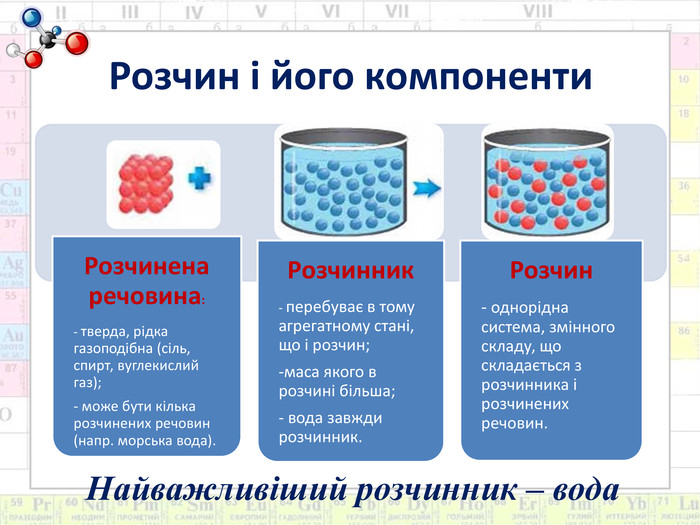



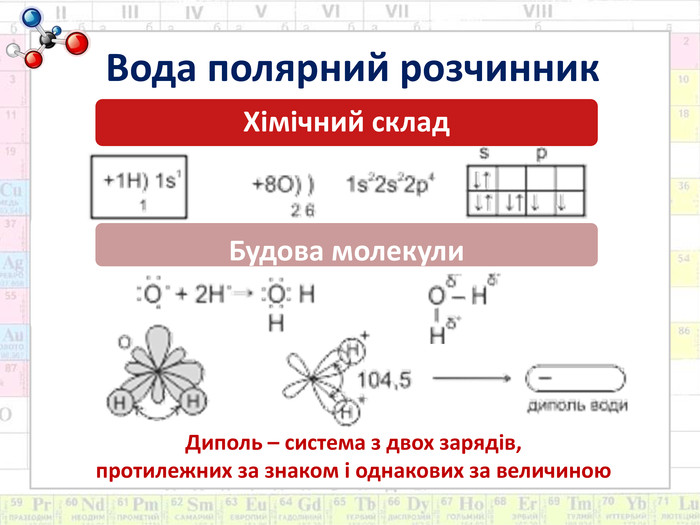
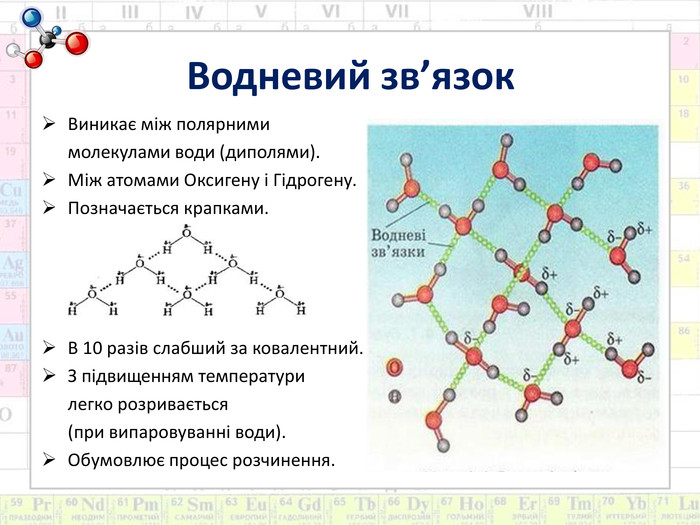






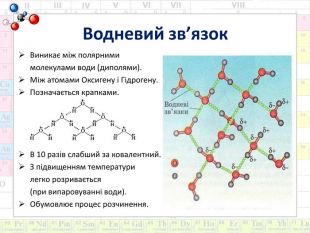
Мета: Сформувати поняття про склад розчинів. Ознайомити з властивостями води як універсального розчинника. Розвивати знання про хімічний зв’язок і будову речовини на прикладі будови молекули води й поняття про водневий зв’язок. Дати уявлення про теплові явища, що супроводжують розчинення речовин, фізико-хімічну суть процесу.
Знайти відповідність: дисперсна система – її класифікація{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}123456 ВБДАЕГ4. Молоко2. Кава1. Піна вогнегасника6. Гель-лак3. Зубна паста5. Цукровий сироп{93296810-A885-4 BE3-A3 E7-6 D5 BEEA58 F35}А. Емульсія. Б. Суспензія. В. Піна. Г. Гель. Д. Золь. Е. Істинний розчин{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}123456
Вода в організмі людини. Доросла людина складається на 70% з води. У людини масою 70 кг міститься 23 кг води. Як же розподілена вода в організмі, адже вона входить в усі тканини і органи?в головному мозку – 71-85%;в крові – 83%;в серці, легенях, нирках – 80%;в кістках – 20 – 30%;в зубній емалі – 0,3%. Втрата тканинами 10% води смертельна
Хімічна теорія розчинів Автор: Д.І. Менделєєв Між розчинником і розчиненою речовиною відбувається хімічна взаємодія (утворюються гідрати) t=-2°C t=+60°C Наливаємо в 2 склянки по 30 мл води і занурюємо в них термометри, температура відповідає кімнатній температурі. В першу (1) додаємо 10 грамів амоній нітрату (NH4 NO3 ). В другу (2) – 10 грамів конц. сульфатної кислоти. Спостерігаємо зміну температур.1)2)
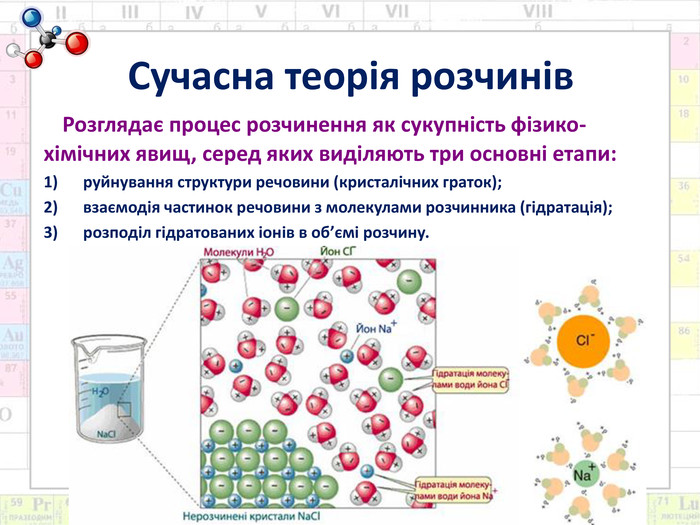
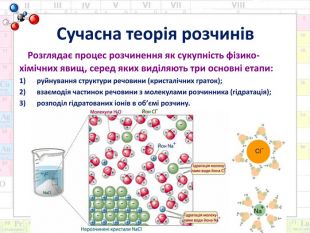
Сучасна теорія розчинів Розглядає процес розчинення як сукупність фізико-хімічних явищ, серед яких виділяють три основні етапи:руйнування структури речовини (кристалічних граток);взаємодія частинок речовини з молекулами розчинника (гідратація);розподіл гідратованих іонів в об’ємі розчину.
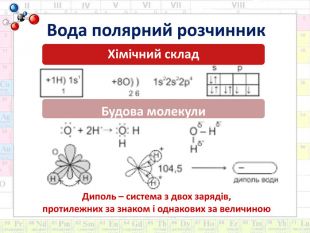
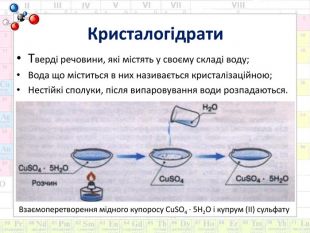
Хімічний диктант1. Процес розчинення – це фізичний процес: а) Так; б) Ні.2. Дифузія – це руйнування кристалів речовини на дрібніші частинки – молекули, йони: а) Так; б) Ні.3. Вода це полярний розчинник: а) Так; б) Ні.4. Чи виникає водневий зв’язок між молекулами води під час кипіння: а) Так; б) Ні.5. Хімічний процес розглядає процес розчинення як хімічну взаємодію між розчинюваною речовиною і розчинником: а) Так; б) Ні.6. Розчин дуже охолоджується, коли енергії не вистачає для процесу розчинення: а) Так; б) Ні.7. Процес утворення сполуки між молекулами розчиненої речовини і водою називається гідратацією: а) Так; б) Ні.8. Хімічний процес розчинення обґрунтував Вант-Гофф: а) Так; б) Ні.9. Відносна молекулярна маса залізного купоросу 250: а) Так; б) Ні.10. Кристалогідрати можна вважати розчинником: а) Так; б) Ні.{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}12345678910баабаааббб{5 C22544 A-7 EE6-4342-B048-85 BDC9 FD1 C3 A}12345678910


про публікацію авторської розробки
Додати розробку














-

Франчук Мар'яна Віталіївна
21.09.2022 в 23:32
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Савєнкова Ольга
06.09.2022 в 18:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Підкалюк Любов Петрівна
15.09.2021 в 21:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Гавдульська Ірина Ярославівна
20.09.2020 в 21:36
Загальна:
1.0
Структурованість
1.0
Оригінальність викладу
1.0
Відповідність темі
1.0
Показати ще 1 відгук