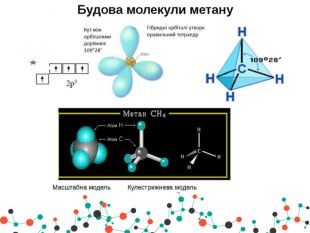
Презентація " Метан та його властивості"













Поширеність у природіМетан є основним компонентом:газів природних горючих (до 99,5 %),нафтових попутних (39—91 %),болотяних (понад 99 %) і рудникових (34—48 %) газів;присутній у газах грязьових вулканів (понад 95 %),спорадично зустрічається у вулканічних газах і в газах магматичних і метаморфічних порід. Цікаво, що Метан присутній також в атмосферах Землі, Марсу, Юпітера, Сатурна, Урану; в газах поверхневого ґрунту Місяця.
Хімічні властивості алканів: Метан являє собою малоактивну в хімічному відношенні речовину. Для метану, як і інших насичених вуглеводнів, типовими є реакції заміщення, при яких атоми водню заміщаються атомами інших елементів або атомними групами.1) Реакція з хлором(заміщення): CH4 + Cl2 → CH3 Cl + HCl. CH3 Cl + Cl2 → CH2 Cl2 + HCl. CH2 Cl2 + Cl2 → CHCl3 + HCl. CHCl3 + Cl2 → CCl4 + HCl2) Реакція горіння (пового окиснення). Метан горить безбарвним полум'ям з виділенням значної кількості тепла: CH4 + 2 O2 → СО2 + 2 Н2 О
3) При нагріванні метану без доступу повітря до температури вище 1000 °C він розкладається на елементи — на вуглець (сажу) і водень:4) При температурі 1500 °C без доступу кисню і наступному охолодженні відбувається піроліз метану до ацетилену і водню: CH4 → С + 2 Н22 CH4 → С2 H2 + 3 H2
Застосування. Велика кількість метану використовується як зручне і дешеве паливо. При використанні в побуті, до метану звичайно додають одоранти зі специфічним «запахом газу». Неповне спалювання метану дає сажу, яка йде на виготовлення друкарської фарби і як наповнювач каучуку, а при термічному розкладі (вище 1000 °C) одержують сажу і водень, який використовують для синтезу амоніаку. Продукт повного хлорування метану — тетрахлорид вуглецю CCl4 — є добрим розчинником жирів і застосовується для екстрагування жирів із зерен олійних рослин. Метан служить також вихідною речовиною для одержання ацетилену, метилового спирту і багатьох інших хімічних продуктів. Метан (природний газ, стиснений природний газ - СПГ, CNG) як моторне пальне – найбезпечніший і екологічно чистий вид пального. Використання СПГ як моторного пального зростає завдяки низці переваг у порівнянні з бензиновим і дизельним паливом.
-
 Воронівська Наталья Гуріївна 18.01.2023 в 16:51Дякую!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Воронівська Наталья Гуріївна 18.01.2023 в 16:51Дякую!Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
 Підкалюк Любов Петрівна 19.01.2022 в 20:57Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0
Підкалюк Любов Петрівна 19.01.2022 в 20:57Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0 -
Іванащенко Олена Афанасіївна 16.01.2021 в 16:42Загальна:5.0Структурованість5.0Оригінальність викладу5.0Відповідність темі5.0


про публікацію авторської розробки
Додати розробку