Презентація: "Відмінність хімічних елементів один від одного. Іони."



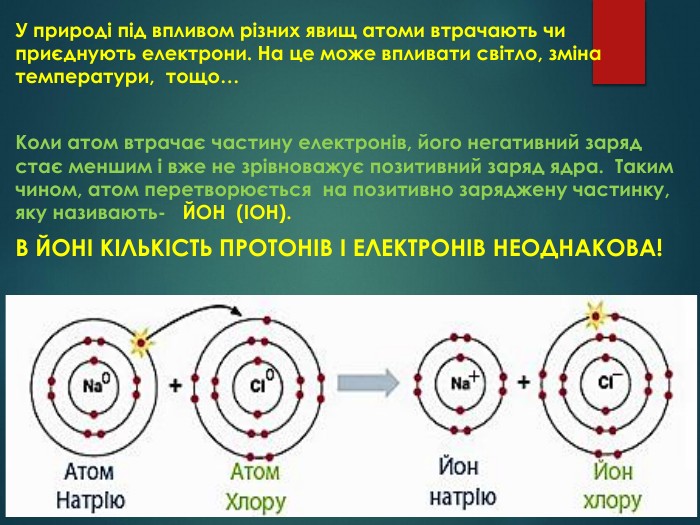









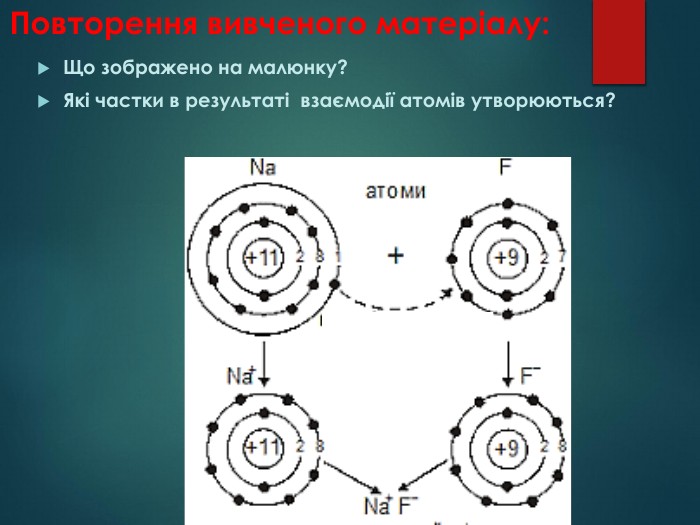

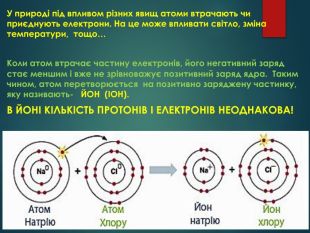
У природі під впливом різних явищ атоми втрачають чи приєднують електрони. На це може впливати світло, зміна температури, тощо… Коли атом втрачає частину електронів, його негативний заряд стає меншим і вже не зрівноважує позитивний заряд ядра. Таким чином, атом перетворюється на позитивно заряджену частинку, яку називають- ЙОН (ІОН). В ЙОНІ КІЛЬКІСТЬ ПРОТОНІВ І ЕЛЕКТРОНІВ НЕОДНАКОВА!
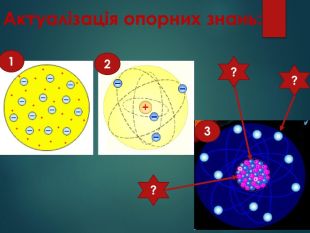
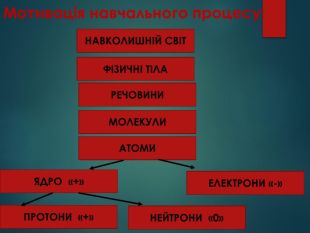
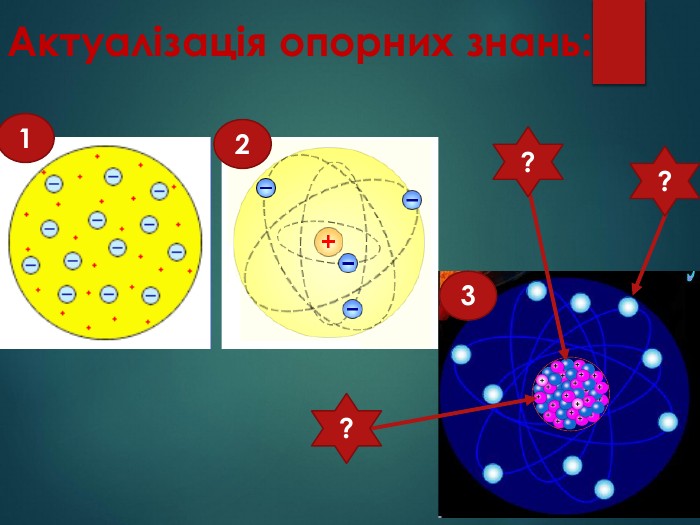
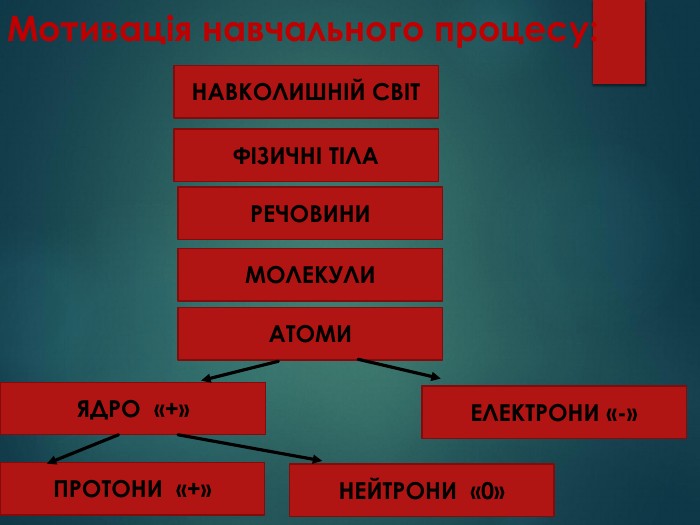
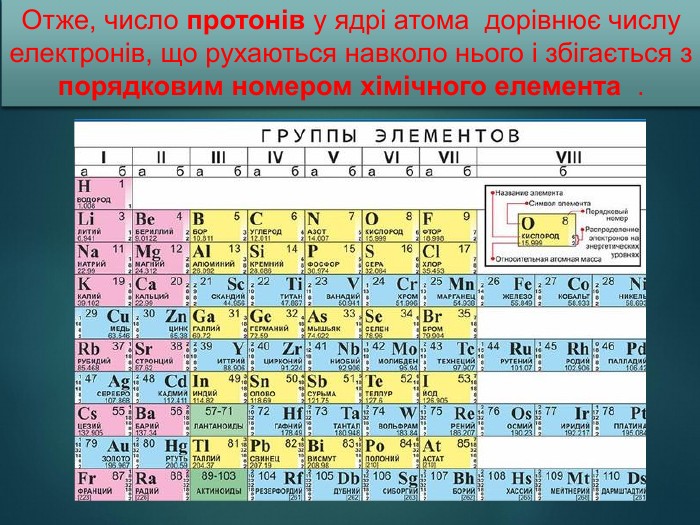
Атом – найдрібніша частинка речовини, що складається з позитивно зарядженого ядра і негативно заряджених електронів. Ядро атома містить елементарні частинки – протони та нейтрони. Протони мають заряд «+», тому ядро завжди позитивно заряджене. Заряд електрона становить « -». Нейтрони незаряджені - «0». В атомі сумарний заряд протонів дорівнює сумарному заряду електронів, тому атом електронейтральний. Отже,
Але в навколишньому світі електронейтральних атомів дуже мало, це, наприклад, атоми Гелію, Неону, Аргону тощо. Частіше атоми або втрачають, або приєднують електрони і стають зарядженими частинками – йонами. Наприклад, натрій хлорид (кухонна сіль) складається з йонів Натрію і йонів Хлору.
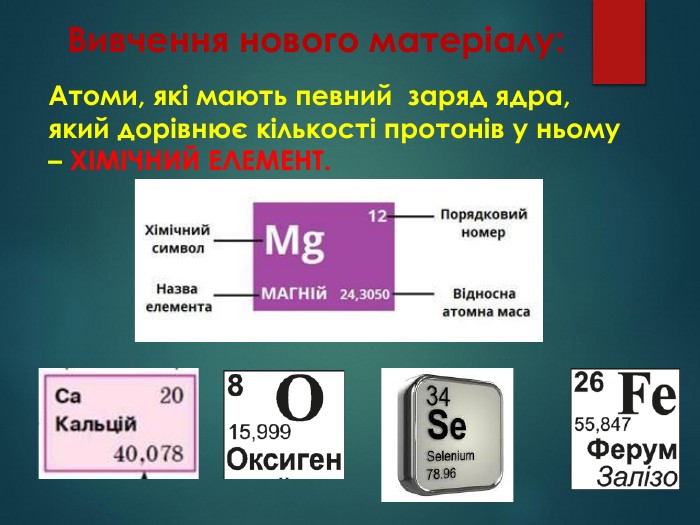
Усі відомі нині речовини, а їх вже понад 15 000 000, утворені з’єднанням атомів різних хімічних елементів. Назви елементів мають різне походження: за властивостями елементів (Водень - породжує воду); на честь планет (Селен – Місяць, Меркурій); з міфології (Тантал, Титан); від географічних назв (Францій, Германій, Каліфорній); на честь учених (Менделєвій , Ейнштейній, Кюрій, Нобелій, Лоуренсій).


про публікацію авторської розробки
Додати розробку