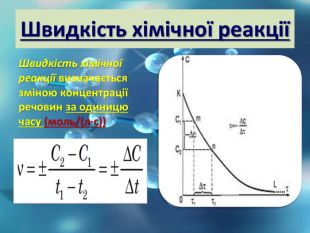
Швидкість хімічної реакції














Завдання а) Концентрація одного з реагентів через 20 секунд після початку реакції становила 0,1 моль/л, а через 30 секунд — 0,02 моль/л. Обчисліть середню швидкість цієї реакції. б) Обчисліть середню швидкість реакції, якщо відомо, що концентрації речовини змінилися так: 1) з 0,5 моль/л до 0, 2 моль/л за 20 секунд; 2) з 0,15 моль/л до 0,1 моль/л за 30 секунд.
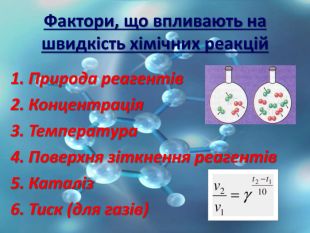
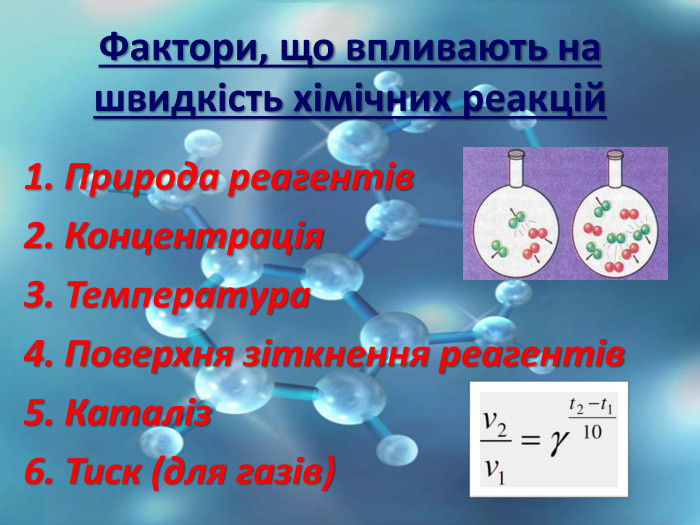
Закон діючих мас (1867 рік) Норвезькі дослідники Гульдберг Като Максиміліан Петер Вааге Швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин, взятих у ступенях рівних їх коефіцієнтам в рівнянні реакції (без урахування твердих речовин). Цей закон ще називають законом діючих мас.
Правило Вант - Гоффа При збільшенні температури на кожні 100С швидкість реакції зростає у 2-4 рази. Величина, що показує, у скільки разів збільшується швидкість реакції, при підвищенні температури на 10оС називається температурним коефіцієнтом, або коефіцієнтом Вант-Гоффа(ɤ) Математичний вираз правила Вант- Гоффа
Завдання 2. У разі підвищення температури на 20°С для реакції, що має температурний коефіцієнт 2, швидкість реакції збільшиться: 1) у 2 рази; 2) у 3 рази; 3) у 4 рази; 4) у 6 разів. Дайте пояснення своїм розрахункам. Завдання 3. Реакція за температури 40°С протікає за 180 с. Температурний коефіцієнт реакції дорівнює 3. За скільки секунд завершиться ця реакція за температури 60°С?
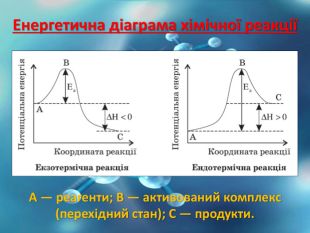
Суть - одна каталізована реакція замінюється кількома проміжними, з меншим енергетичним ефектом Каталіз — зміна швидкостей хімічних реакцій чи їх збудження внаслідок дії речовин (каталізаторів), які беруть участь у процесах, однак не входять до складу кінцевих продуктів. Зазвичай під терміном каталіз розуміють явище, коли в присутності каталізатора відбувається «позитивний каталіз», тобто збільшення швидкості реакції.
Встановіть відповідність А) Харчові продукти довше зберігаються у вакуумних упаковках Б) Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують. В) Улітку зростає небезпека харчових отруєнь. Г) Термін служби мідних водопровідних труб значно більший порівняно зі сталевими. 1) Зі зростанням температури швидкість реакції збільшується. 2) Зі зростанням площі поверхні контакту реагентів швидкість реакції зростає. 3) Зі зменшенням концентрації реагентів швидкість реакції зменшується. 4) Швидкість реакції залежить від природи реагентів.
Перевіряємо результат А) Харчові продукти довше зберігаються у вакуумних упаковках Б) Аби пришвидшити випалювання залізної руди, її подрібнюють і розпорошують. В) Улітку зростає небезпека харчових отруєнь. Г) Термін служби мідних водопровідних труб значно більший порівняно зі сталевими. 1) Зі зростанням температури швидкість реакції збільшується. 2) Зі зростанням площі поверхні контакту реагентів швидкість реакції зростає. 3) Зі зменшенням концентрації реагентів швидкість реакції зменшується. 4) Швидкість реакції залежить від природи реагентів.


про публікацію авторської розробки
Додати розробку