Урок фізики в 9 класі "Сучасна модель атома. Протонно-нейтронна модель ядра атома."
Тема уроку: Сучасна модель атома. Протонно-нейтронна модель ядра атома.
Мета уроку: сформувати уявлення про атом і атомне ядро, ознайомити учнів з
дослідом Резерфорда, розглянути планетарну модель атома;
розвивати логічне мислення, вчити робити висновки та
узагальнення;
виховувати почуття відповідальності за збереження
навколишнього середовища.
Тип уроку: урок засвоєння нових знань.
Обладнання: модель досліду Резерфорда;
періодична таблиця елементів Д. І. Менделєєва;
портрети видатних вчених: Менделєєва, Томсона, Резерфорда;
дидактичний матеріал .
ХІД УРОКУ
І. Мотивація навчальної діяльності. Повідомлення теми і мети уроку. Методичний прийом «Здивуй!»
Багато-хто з вас чув про запуск осінню 2008 р. потужної фізичної установки - великого адронного колайдера . Витрати на його створення були величезними: Німеччина, Франція, Японія об'єднали свої зусилля, щоб побудувати це диво техніки.
Про те, навіщо розщеплювати атомні ядра і чому уряди різних країн у великих обсягах фінансують досліджування першооснови матерії, ви дізнаєтеся при вивченні цієї теми.
На початку 20-го століття з'ясувалося, що складним є не тільки атом, але й атомне ядро: воно складається з протонів і нейтронів. А в другій половині 20-го століття встановили, що й ці частки є складними: вони складаються з часток, названих кварками. Ці частки з дробовим електричним зарядом не існують у вільному стані. Вивчення атомного ядра відкрило перед людством нові джерела енергії, і сьогодні в багатьох країнах світу працюють атомні електростанції. Однак відкриття таємниць атомного ядра принесло й нові проблеми, які можна вирішити, тільки об'єднавши зусилля всього людства. Мирний атом 26 квітня 1986 р. з усією гостротою поставив питання про відповідальність учених, про такі поняття, як совість, людяність, про те, чи маємо ми право заради сьогоднішніх ілюзій ризикувати здоров'ям і життям майбутніх поколінь. Про атом сьогодні й піде мова на нашому уроці. Але, перш ніж перейти безпосередньо до вивчення теми, пригадаємо, що ж ми знаємо про це поняття.
ІІ. Актуалізація опорних знань.
Згадаємо будову атомного ядра та атомного ядра
Відомо, що атом складається з ядра та електронної хмари навколо. Ядро, у свою чергу, містить частинки двох видів: протони, які мають позитивний електричний заряд, і нейтрони - частинки, які не мають заряду. Маса протона приблизно дорівнює масі нейтрона і майже у 2000 разів більша за масу електрона. Протони й нейтрони, що входять до складу ядра атома, називають нуклонами. Сумарну кількість протонів і нейтронів в атомі називають нуклонним (або масовим) числом та позначають символом А.
Атом є електронейтральним, тобто сумарний заряд протонів, що містяться у ядрі, дорівнює сумарному заряду електронів, що обертаються навколо ядра. А оскільки заряд протона за модулем дорівнює заряду електрона, то зрозуміло, що в атомі кількість протонів дорівнює кількості електронів.
Кількість протонів у ядрі називають протонним (або зарядовим) числом та позначають символом Z. Його легко визначити, скориставшись Періодичною системою хімічних елементів Д. І. Менделєєва. Порядковий номер елемента у періодичній таблиці відповідає кількості протонів у ядрі (протонному числу).
zXА
Знаючи протонне (Z) і нуклонне (А) числа ядра хімічного елемента, можна визначити кількість нейтронів (N) у ядрі цього елемента: N=А-Z.
При позначенні ядра атома хімічного елемента перед символом елемента вверху вказується нуклонне число А, а внизу — протонне число Z. Наприклад, 13АІ27 - ядро Алюмінію, що має нуклонне число 27 та протонне число 13. Цей запис означає, що в ядрі атома Алюмінію міститься 27 нуклонів: 13 протонів і 27-13 = 14 нейтронів.
Фронтальне опитування .Методичний прийом «ланцюжок».
1.Що означає слово «атом»?
2.Хто ввів це поняття у фізику?
3.Скільки видів атомів зараз відомо вченим?
4.Що таке електрон?
5.Який його заряд?
6.Який заряд ядра?
7.Як взаємодіють заряджені частинки?
ІІІ. Вивчення нового матеріалу
Дізнаємося про ядерну фізику
Ядерна фізика - це розділ фізики який вивчає структуру і властивості атомного ядра, процеси, що в ньому відбуваються, та механізми його перетворень. Атомарне вчення пройшло довгий і складний шлях. Пригадаємо деякі основні етапи.
У перекладі з грецької «атом» означає «неподільний». Довгий час вчені вважали атоми неподільними «цеглами світобудови». Передбачалося, що всі речовини складаються з декількох десятків різних типів атомів.
Важливу роль у розумінні природи атома відіграв періодичний закон, відкритий у 1868 р. Д. Менделєєвим, який свідчить про складність атомів елементів.
Відкриття електрона Дж. Дж. Томсоном
Вчення про неподільність атома виявилося під сумнівом, коли наприкінці 19-го століття англійський фізик Дж. Дж. Томсон відкрив електрон. Маса електрона виявилася приблизно у дві тисячі разів менше атома, а це означало, що електрони якимось чином входять до складу атомів, тобто атоми повинні бути складними об'єктами. Відкриття електрона було одним з найважливіших досягнень фізики кінця 19-го століття, і воно безпосередньо пов'язане з ім'ям Томсона, відзначеного за нього в 1906 році Нобелівської премії. У тім же 1897 році, коли було зареєстроване відкриття електрона, Томсон звернувся до проблеми атома. Він прийшов до переконання, що, всупереч своїй назві, атом не є неподільним, Томсон запропонував його модель. По цій моделі атом виступав у вигляді позитивно зарядженої «краплі», усередині якої «плавали» маленькі негативно заряджені кульки - електрони. Сумарний негативний заряд електронів дорівнює позитивному заряду кулі, тому атом загалом нейтральний.
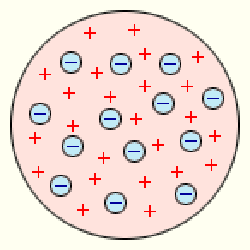 Модель атома Дж. Томсона.
Модель атома Дж. Томсона.
Класичний дослід Резерфорда
Досліди, проведені згодом у тій ж кавендишевській лабораторії спадкоємцем Томсона, Э. Резерфордом змусили відмовитися від цієї моделі на користь «планетарної» моделі, тому що Резерфорд відкрив, що усередині атома є дуже мале ядро, у якому зосереджена практично вся маса атома. В 1908-1911 рр. під його керівництвом були виконані досліди з розсіювання α-частинок металевою фольгою.
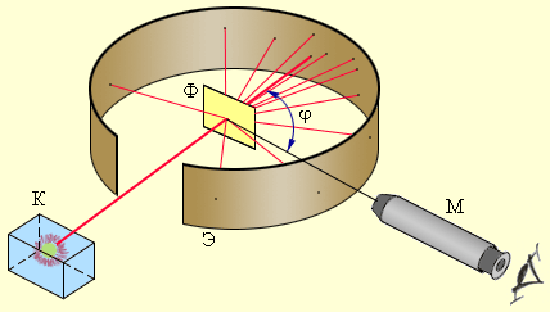
Схема досвіду Резерфорда по розсіюванню α-часток. K - свинцевий контейнер з радіоактивною речовиною, Э - екран, покрита сірчистим цинком, Ф - золота фольга, M - мікроскоп.
Результати досліду:
- Більшість α-частинок проходила крізь фольгу, не змінюючи напряму або відхилившись на невеликий кут.
- Деякі α-частинки відхилялись на кут 135о-150о; одна із 20000 α-частинок поверталася назад.
Резерфорд: «Це було так неймовірно, ніби ви вистрілили 15-дюймовим снарядом в аркуш папіросного паперу, а снаряд повернувся б назад і потрапив у вас».
Методичний прийом «Мікрофон»
Які б висновки ви зробили із досліду Резерфорда?
● В атомі є пустоти;
● α-частинка проходить біля якихось заряджених частинок;
● α-частинка взаємодіє із позитивно зарядженою частинкою, але більшої маси.
На основі цього сформувалася планетарна модель атома:
1.Атом складається з позитивно зарядженого ядра, у якому сконцентрована майже вся маса атома. Розміри ядра порядку 10-14-10-15м (атома -10-10м).
2.Навколо масивного ядра по замкнених орбітах рухаються легкі електрони, загальний негативний заряд яких дорівнює позитивному заряду ядра атома.
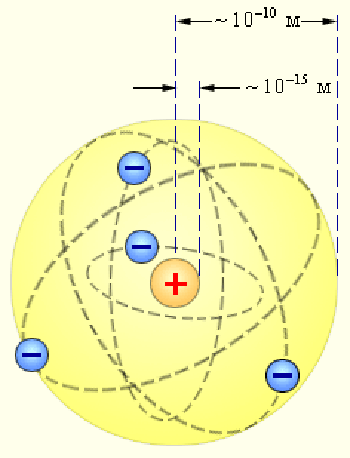
Планетарна модель атома Резерфорда.
З'ясуємо будову ядра атома:
● Ядро складається з позитивно заряджених частинок (протонів-p) і нейтральних частинок (нейтронів-n), які називаються нуклонами. Їх число відповідає масовому числу елемента в таблиці Менделєєва - А.
● Порядковий номер у таблиці Менделєєва вказує на заряд ядра-кількість протонів та кількість електронів в атомі в нормальному стані - Z.
● Нейтронів в атомі: N = A - Z.
Ядра хімічних елементів позначають символом ZХА, де X – хімічний символ елемента. Наприклад, 1Н1 – водень, 2Не4– гелій, 8О16– кисень.
Сильні взаємодії
Вам уже відомо, що електрони маючи негативний заряд, утримуються навколо позитивного ядра завдяки електромагнітній взаємодії. Але яким чином у складі одного ядра і на дуже близькій відстані один від одного утримуються протони, адже однойменно заряджені частинки відштовхуються?
Фізики з'ясували, що всі частинки всередині ядра притягуються одна до одної, причому байдуже які: протон до протона, протон до нейтрона, нейтрон до нейтрона. І це відбувається завдяки взаємодії іншого виду, яка набагато сильніша, ніж електромагнітне відштовхування протонів. Саме тому взаємодію нуклонів називають сильною взаємодією.
ІV. Закріплення нових знань
Розв’язування задач:
1. Скільки нуклонів, протонів і нейтронів міститься в ядрах наступних елементів:
13Al27 A = 27, Z = 11 , N = 27 –13= 14;
4B 9 A = 9. Z = 4, N = 9 – 4 = 5:
82Pb207 A = 207, Z = 82, N =207 – 82 = 125 .
2 . Чим відрізняються наступні елементи :
8О17 і 8О16 92U235 і 92U239
V. Підведення підсумків уроку
Сьогодні суспільна значущість ядерної фізики полягає в можливості забезпечити людство високоефективними джерелами енергії на тривалий період.
У результаті дослідів, проведених під керівництвом Е. Резерфорда, було висунуто ядерну модель будови атома, згідно з якою атом містить позитивно заряджене важке ядро, що займає невеликий об'єм усередині атома, і негативно заряджені електрони. При цьому електронна хмара займає майже весь об'єм атома, але її маса є незначною порівняно з масою атома.
Ядра атомів складаються з нуклонів — протонів і нейтронів. Кількість протонів у ядрі атома даного елемента дорівнює порядковому номеру цього елемента в періодичній системі хімічних елементів. У ядрі нуклони втримуються разом завдяки сильній взаємодії, яка значно сильніша за електромагнітну.
Результати досліджень ядерної фізики втілилися сьогодні в радіаційних технологіях, які застосовуються в медицині, геології, сільському господарстві та в інших галузях. Проте найважливіша сфера застосування досягнень ядерної фізики - отримання енергії. За короткий проміжок часу в розвинутих країнах світу частка електричної енергії, що одержують за рахунок розщеплення атомних ядер, стала дорівнювати десяткам відсотків, а в деяких країнах, у тому числі в Україні, сягнула половини загального видобутку енергії.
Стрімкий розвиток ядерної енергетики пов'язаний з високою ефективністю ядерного «палива». На думку фізиків, коли будуть розгадані таємниці будови мікрочастинок, які входять до складу ядра, відкриються ще більші можливості.
VІ. Повідомлення домашнього завдання
Домашнє завдання: опрацювати § 22, визначити склад ядра й атома декількох хімічних елементів.


про публікацію авторської розробки
Додати розробку
