Урок на тему "Електроліти та неелектроліти. Електролітична дисоціація."
Урок № 8
Тема: Електроліти та неелектроліти. Електролітична дисоціація.
Цілі уроку:
дидактичні: поглибити знання про залежність властивостей від будови речовин (електроліти та неелектроліти), вдосконалити вміння конспектувати, робити висновки.
розвивальні: продовжити формувати вміння формулювати визначення розвивати просторове уявлення, вміння порівнювати і аналізувати.
виховні: сприяти вихованню згуртованості класу, розвивати вміння працювати самостійно та в групі, сприяти формуванню у кожного учня розуміння своєї значимості.
Тип уроку: урок засвоєння нових знань.
Форма уроку: пояснення вчителя.
Обладнання та матеріали: ПСХЕ; таблиця розчинності солей, кислот і основ; установка для демонстрації електропровідності розчинників і розплавів; вода водопровідна і дистильована; розчин хлоридної кислоти, натрій гідроксиду, цукор; тверді зразки кальцій гідроксиду, натрій хлорид, цукор.
Базові поняття й терміни: Розчини, розчинник, електроліт, неелектроліт, розчинена речовина, розчинність, електропровідність, хімічний зв'язок, кристалічна решітка.
«Хімік без знання фізики подібний до людини, яка повинна шукати навпомацки. »
М.В. Ломоносов
ХІД УРОКУ
I. Організація класу
II. Оголошення теми й цілей уроку.
III. Мотивація навчальної діяльності.
З курсу природознавства й фізики ми пам'ятаємо, що метали проводять електричний струм.
• Хто може пояснити, чому ця властивість притаманна металам?
(Металевий зв'язок, металеві кристалічні ґратки, вільні електрони в кристалічних ґратках і катіони у вузлах)
• Чи проводить електричний струм вода?
(Так, ні)
Нагадуємо, що електричні прилади не можна гасити водою, не можна торкатися електричних дротів, електричних приладів мокрими руками. Чому?
(Тому що водопровідна вода проводить електричний струм)
Проблемне питання:
- Чим відрізняються дистильована й водопровідна вода?
(Наявністю розчинених у них солей)
- Чи всі речовини здатні так змінювати воду?
Речовини, розчини й розплави яких проводять електричний струм, називаються електролітами.
(До них належать усі солі, кислоти, основи, більшість основних оксидів, тобто речовини з йонним і ковалентним полярним типами зв'язку.)
Речовини, розчини й розплави яких не проводять електричний струм, називаються неелектролітами.
(Це прості речовини — неметали, речовини немо-лекулярної будови, більшість органічних речовин)
IV. Вивчення нового матеріалу
Електролітична дисоціація
Чому розчини й розплави кислот, основ і солей проводять електричний струм?
Давайте вивчимо поведінку речовин у водному і неводному розчині на прикладі хлориду натрію.
Дослід 1.: електроди опускаємо в склянку з кристалами натрію хлориду(лампочка не загоряється).
Дослід 2.: електроди опускаємо в склянку з розчином натрію хлориду (лампочка загоряється).
З результату досвіду зробимо висновок, що під впливом води речовини зазнають змін. Вода змушує електроліти розпадатися на йони. Цей процес називається дисоціацією.
Даний процес вивчав шведський вчений Сванте Арреніус.
Давайте послухаємо повідомлення вашої однокласниці про його заслуги в хімії (диск № 2: портрет Сванте Арреніуса)
Будучи прихильником фізичної теорії розчинів, шведський вчений Сванте Арреніус, не зміг відповісти на питання: чому саме у водному розчині відбувається дисоціація солей та лугів? Відповідь на нього дали російські хіміки Каблуков, Кистяківський. Суть їх доповнень полягає в наступному (під запис): причиною дисоціації електроліту в розчині є його гідратація, тобто взаємодію з молекулами води. І іони, які утворюються при дисоціації будуть гідратованими, тобто пов'язаними з молекулами води, і їх властивості будуть відрізнятися від негідратірованних.
Необхідно згадати особливості будови молекули Н2О (диполь, з ковалентним полярним зв'язком).
Що ж із себе представляє молекула води? В цілому молекула води не заряджена. Але всередині молекули води атоми Оксигену і Гідрогену розташовуються так, що позитивні і негативні заряди знаходяться в протилежних кінцях молекули. Тому молекула води являє собою диполь:
![]()
![]()
![]()
![]()
![]()

109028/
![]()
![]()
Уявлення про дисоціацію у водних розчинах сполук сформувалися не відразу. Сванте Арреніус та інші прихильники фізичної теорії назвали цей процес електролітичною дисоціацією.
Електролітична дисоціація — це розпад електролітів на йони в розчині або розплаві.
Основні положення теорії електролітичної дисоціації (ТЕД) сформулював шведський учений Сванте Арреніус у 1887 р., за що в 1901 р. отримав Нобелівську премію з хімії.
Розглянемо механізм дисоціації хлориду натрію при розчиненні.
Який тип зв'язку у цього з'єднання? (Іонний).
(Диск № 2: дисоціація речовин з йонним структурою).
Відзначу, що легше всього дисоціюють електроліти, які мають йонну структуру.
Дисоціація речовин з іонним зв'язком протікає в три стадії:
- спочатку хаотично рухаються молекули води у йонів кристалу орієнтуються до них протилежно зарядженими полюсами - відбувається орієнтація.
- потім диполі води притягуються, взаємодіють з йонами поверхневого шару кристала відбувається гідратація.
- молекула води, переміщаючись в розчин, захоплюють з собою гідратовані йони. Відбувається дисоціація.
А як реагують з молекулами води полярні молекули електроліту?
Аналогічно, але на одну стадію більше (диск № 2: дисоціація речовин з ковалентно-полярної зв'язком):
- орієнтація
- гідратація
- іонізація, тобто перетворення ковалентно-полярного зв'язку в йонну.
- дисоціація
Таким чином електролітична дисоціація - процес розпаду електроліту на іони при розчиненні.
Уявимо собі, що іонний кристал, наприклад кристал натрій хлориду, внесений у водуутворює навколо себе електростатичне поле. Поблизу від Na+ створюється поле позитивного знаку, а поблизу Cl- - негативне. Вплив цих полів простягається на деяку відстань від кристала. У розчині кристал з усіх боків оточують полярні молекули води, що безладно рухаються. Потрапляючи в поле дії електрично заряджених іонів, вони змінюють свій рух (мал.2): у безпосередній близькості від кристала вони орієнтуються таким чином, що до негативно зарядженого іона хлора диполі води виявляються направленими позитивно зарядженим кінцем, а до позитивно зарядженого іона натрію – негативним кінцем. 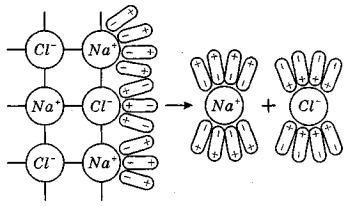
Мал.2. Механізм електролітичної дисоціації натрій хлориду
Таке явище, яке відбувається в електростатичному полі, називається орієнтацією полярних молекул. Між йонами і диполями води діють кулонівські сили притягнення. В результаті іон-дипольної взаємодії виділяється енергія, яка сприяє розриву іонних зв'язків в кристалі і переведенню іона з кристала в розчин (мал.2).
Відокремлені один від одного йони одразу ж після розриву зв'язку між ними впритул оточуються полярними молекулами води і стають повністю гідратованими іонами. Явище взаємодії іонів з молекулами води, внаслідок чого відбувається утворення гідратної оболонки, називається гідратацією йонів. Теплота, що виділяється при гідратації іонів, називається теплотою гідратації.
Гідратовані йони, що мають протилежні заряди, можуть взаємодіяти один з одним. Але оскільки іони рухаються в розчині разом з гідратними оболонками, що утворилися навколо них, то сила їх взаємодії значно менша і вони здатні до самостійного існування. Сила взаємодії гідратованих іонів залежить від властивостей розчинника, одним з яких є діелектрична проникненість.
Діелектрична проникненість показує в скільки разів сила взаємодії між двома зарядами в даному середовищі менша, ніж у вакуумі.
З урахуванням гідратації іонів рівняння електролітичної дисоціації електролітів слід було б записувати так:
NaCl + xH2O = Na+nH2O + Cl-mH2O
З огляду на те, що склад гідратованих іонів не завжди сталий і зв'язок не дуже міцний, ці рівняння записують спрощено:
NaCl = Na+ + Cl-
Розглянемо розчинення полярних сполук на прикладі HCl. При розчиненні гідроген хлориду у воді відбувається орієнтація диполів води навколо розчинених молекул, що викликає ще більшу поляризацію молекул гідроген хлориду (рис.3). 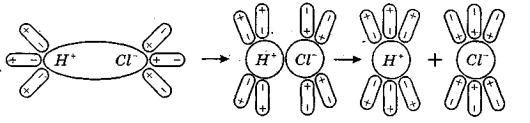
Рис.3. Механізм електролітичної дисоціації гідроген хлориду.
Полярний зв'язок між атомами гідрогена і хлора переходить в іонний. При цьому спільна електронна пара цілком зміщується до атома хлора, який перетворюється на гідратований іон хлора, а протон з молекулою води утворює складну позитивно заряджену частку Н3О+, що називається гідроксонієм.
НСl + xH2O = H3O+ + Cl-(x-1)H2O
Оскільки гідратована частка Н3О+ і гідратований іон хлора в рівняннях електролітичної дисоціації можуть бути замінені знаками іона гідрогена і хлора, то рівняння можна записати так:
НСl = H+ + Cl-
З наведених прикладів видно, що електролітами можуть бути тільки сполуки з іонним або полярним зв'язком, тобто солі, основи і кислоти. З'ясувалася і роль розчинника: електроліти можуть дисоціювати на іони тільки в полярних розчинниках.
Електроліти істотно відрізняються від твердих провідників електричного струму – металів, графіту, вугілля. У останніх провідність здійснюється електронами.
Гідратовані іони в розчині знаходяться в постійному безладному русі. Якщо за допомогою батареї створити на електродах, поміщених у розчин, на одному позитивне електричне поле, а на іншому негативне, то гідратовані іони будуть направлено рухатись.
Позитивно заряджені йони (йони металів і Гідрогену) починають рухатися до негативного електроду – катода, а тому вони і одержали назву катіонів.
Негативно заряджені йони (йони неметалів, водних і кислотних залишків) рухаються до позитивно зарядженого електроду – анода, і називаються тому аніонами.
Катіони на катоді приймають електрони і перетворюються на атоми, а аніони на аноді віддають зайві електрони, перетворюючись на незаряджені частинки. Таким чином, у електролітів носіями електронів є іони.
За своїми властивостями іони відрізняються від атомів. Так, атоми натрію взаємодіють з водою, витісняючи з неї гідроген. Гідратовані іони натрію цієї здатності не мають; молекули і атоми хлора мають зеленувате забарвлення, задушливий запах, а гідратовані іони хлора безбарвні і не мають запаху; молекули і атоми водню утворюють безбарвний горючий газ, погано розчинний у воді, а іони гідрогена не горять і існують у водних розчинах у вигляді складної частинки Н3О+.
Слід враховувати, що в розчинах електролітів хаотично рухаються іони можуть зіткнутися і з'єднатися в молекулу. Це процес асоціації.
Зверніть увагу на знак, що стоїть в рівнянні дисоціації.
(Диск № 1: написання рівняння дисоціації). Оскільки число молекул води, яке приєднують іони, невідомо, то процес дисоціації електролітів зображають спрощено:
NaCl = Na+ +Cl-
Для прикладу запишіть скорочене рівняння дисоціації деяких речовин з йонним будовою: Ca(OH)2, Na2SO4, Na3PO4, Al2(SO4).
На сьогоднішньому уроці ви дізналися, що таке електролітична дисоціація, механізм дисоціації.
Виходячи з усього сказаного, скажіть, які процеси зашифровані у вірші:
Живодинкристаліонний,
Для іонів будинок величезний,
Був гарний він і рівний.
Але трапилася з ним біда.
Крапля на нього впала,
І кристала вмить не стало:
На йони розпластала
Його спритна вода.
Все сімейство здивувалося:
«Що зовні приключилося?»
Це поруч з'явилася раптом молекул череда,
Підбігли шумним роєм,
Оточили щільним строєм:
«Запропонувати хочемо героям
нашу дружбу назавжди ... »
Воднем до аніонам,
Гідроксидом до катіонів,
Не піти від них іонам
Ні туди і ні сюди.
(Розчинення речовини з йонним зв'язком, орієнтація молекул води, гідратація, дисоціація)
Отже:
Основні положення ТЕД
• Дисоціація електролітів відбувається під дією полярних молекул розчинника.
• Дисоціація — оборотний процес. Зворотний процес називається асоціацією.
• Молекули, що дисоціюють, розпадаються на катіони й аніони, причомузаряд усіх катіонів дорівнює сумарному заряду всіх аніонів.
Під дією електричного струму в розчині виникає спрямований рух катіонів — до катода, аніонів — до анода.
Уперше припущення, що в розчині відбувається сполучення речовини й розчинника, висловив Д. І. Менделєєв.
Згодом І. О. Каблуков і В. О. Кистяківський об'єднали обидві теорії й показали, що розчинення — складний фізико-хімічний процес.
Приклади дисоціації.
Лабораторний дослід № 1.
Визначення йонів Н+ і ОН- у розчинах.
Інструктаж з техніки безпеки.
Дослід № 1
Перед вами дві пробірки, імовірно, у них містяться НС1 і КОН. Як дослідним шляхом визначити, у якій із них міститься луг, а в якій — кислота?
Використаємо фенолфталеїн і лакмус. Приклеюємо етикетки на склянки.
Дослід № 2
Досліджуємо розчини імовірних кислот і лугів універсальним індикаторним папірцем.
Індикатор визначає наявність йонів Н+ і ОН- у розчинах.
Фенолфталеїн — тільки йони ОН-.
Лакмус стає червоним за наявності йонів Н+і синім — за наявності йонів ОН-
Висновок: у розчинах кислот міститься Н+, у розчинах лугів— ОН-. Доведемо це, записавши рівняння дисоціації.
Завдання 1
У прилад для перевірки електропровідності налили розчин барій хлориду. Після вмикання в мережу лампочка загорілася (тобто розчин проводить струм). Потім до цього розчину по краплях доливали сульфатну кислоту. Що відбувалося з лампочкою? Поясніть ваші припущення.
Завдання 2
Розчин КС1 — безбарвний, а розчин КМnО4 має фіолетове забарвленні Який йон спричиняє забарвлення розчину КМnО4 ?
Завдання 3
Розчин NаСІ — не токсичний, а розчин СиС12 — токсичний. З яким йоном пов'язана токсичність СиС12?
V. Самостійна робота за варіантами
Напишіть рівняння дисоціації запропонованих речовин.
Варіант І
Nа2SiO3, НNO3, LiОН, Са(ОН)2, КОН, FеSО4, Сг2(SО4)з, Nа3РО4, Н2S, Н3РО4.
Напишіть рівняння дисоціації запропонованих речовин.
Варіант II
ZnС12, HNO3, МgSО4, Ва(ОН)2, А1С13, Ва(NO3)2, Мg3(РО4)2, Н2SО3, К2SiO3, СsОН.
VI. Підбиття підсумків уроку
Взаємоперевірка самостійної роботи, коригування навичок складання рівнянь дисоціації, виставлення оцінок.
VІI. Домашнє завдання
§6 ст. 32-36. Опрацювати матеріал параграфа, відповісти на запитання до нього, виконати вправу:
Написати рівняння дисоціації в розчинах таких речовин: К2SО4, Н2SO4, ВаС12, НВг, А1С13.


про публікацію авторської розробки
Додати розробку
