Внутрішня енергія. Закони термодинаміки
Внутрішня енергія
Закони термодинаміки
Внутрішня енергія тіл
Одним з найважливіших параметрів термодинамічної системи є її внутрішня енергія. Будь-яке макроскопічне тіло має внутрішню енергію. Поняття внутрішньої енергії макроскопічних тіл відіграє важливу роль у дослідженнях теплових явищ. Це зумовлено існуванням фундаментального закону природи — закону збереження енергії.
Відкриття закону збереження енергії стало можливим після того, як було доведено, що, крім механічної енергії, макроскопічні тіла мають ще й внутрішню енергію, яка зосереджена в самих тілах. Ця енергія входить до загального балансу енергетичних перетворень у природі.
З погляду молекулярно-кінетичної теорії внутрішня енергія макроскопічного тіла дорівнює сумі кінетичних енергій хаотичного руху всіх молекул (або атомів) відносно центра маси тіла і потенціальних енергій взаємодії всіх молекул одна з одною (але не з молекулами інших тіл).
До внутрішньої енергії відносять також і енергію, зв’язану з обертальними і коливальними рухами молекул, кінетичну і потенціальну енергію атомів, які утворюють молекулу (цю енергію називають хімічною), електронів і атомних ядер (внутрішньоатомну енергію), частинок, які входять до складу ядра (внутрішньоядерну енергію). Але оскільки в молекулярній фізиці розглядаються явища, під час яких відбуваються зміни лише кінетичної і потенціальної енергії молекул, а решта складових внутрішньої енергії не змінюється, надалі під внутрішньою енергією ми будемо розуміти енергію хаотичного руху молекул і енергію їх взаємодії.
Обчислити внутрішню енергію тіла, підраховуючи енергію всіх взаємодіючих між собою багатьох мільярдів частинок, практично неможливо, оскільки закони залежності сил взаємодії атомів і молекул від відстані між ними складні, а взаємне розміщення частинок внаслідок теплового руху безперервно змінюється. Також хаотично змінюється і кінетична енергія окремих частинок. Тому потрібно вміти визначати середнє значення внутрішньої енергії (або її зміну) залежно від макроскопічних параметрів, які можна безпосередньо виміряти.
Простий розв’язок ця задача має для випадку ідеального газу. Внутрішня енергія ідеального газу становить суму лише кінетичних енергій теплового руху його частинок, оскільки взаємодією частинок в ідеальному газі можна знехтувати. Найпростіше можна обчислити внутрішню енергію ідеального одноатомного газу (гелію, неону, аргону та ін.), бо його молекули здійснюють лише поступальний рух.
Середня кінетична енергія молекул такого газу дорівнює. Тому внутрішня енергія газу, який складається з N молекул, дорівнює ![]() . Оскільки
. Оскільки
![]() , то
, то ![]() .
.
Внутрішня енергія ідеального одноатомного газу залежить лише від одного параметра — його абсолютної температури ![]() . Вона не залежить від об’єму та інших макроскопічних параметрів системи. Зміна внутрішньої енергії даної маси ідеального газу відбувається лише за зміни його температури:
. Вона не залежить від об’єму та інших макроскопічних параметрів системи. Зміна внутрішньої енергії даної маси ідеального газу відбувається лише за зміни його температури:
![]()
Під час нагрівання газу його внутрішня енергія збільшується, а під час охолодження — зменшується.
Якщо збільшити масу газу, то збільшиться і його внутрішня енергія (U~m). Внутрішня енергія залежить від виду газу, тобто від його молярної маси: ![]() чим більше М, тим менше атомів буде в даній масі газу.
чим більше М, тим менше атомів буде в даній масі газу.
Якщо молекули ідеального газу складніші, ніж одноатомні, то його внутрішня енергія також пропорційна абсолютній температурі, але коефіцієнт пропорційності між U і Т інший. Це пояснюється тим, що складні молекули не лише рухаються поступально, а й обертаються. Внутрішня енергія таких газів дорівнює сумі енергій поступального й обертального руху молекул.
Ми встановили, що внутрішня енергія ідеального газу залежить від одного параметра — температури. Від об’єму внутрішня енергія ідеального газу не залежить через те, що потенціальна енергія взаємодії його молекул, як вважають, дорівнює нулю.
У реальних газів, рідин і твердих тіл середня потенціальна енергія взаємодії молекул не дорівнює нулю. Щоправда, для газів вона набагато менша за середню кінетичну енергію, але для твердих і рідких тіл порівнянна з кінетичною. Середня потенціальна енергія взаємодії молекул залежить від об’єму речовини, оскільки зі зміною об’єму змінюється середня відстань між молекулами. Отже, в загальному випадку внутрішня енергія разом з температурою Т залежить ще й від об’єму V.
Макроскопічні параметри Т, V та інші визначають стан тіл. Від них залежить і внутрішня енергія макроскопічних тіл. Внутрішня енергія U макроскопічних тіл однозначно визначається параметрами, що характеризують стан тіла: температурою і об’ємом.
Кількість енергії, переданої від одного тіла до другого, називають по-різному залежно від способу передачі. Якщо способом передачі є виконання механічної роботи, то кількість переданої енергії так і називають — робота. Якщо ж енергія передається внаслідок теплопередачі, то передану енергію називають кількістю теплоти. Таким чином, кількість теплоти, передана чи набута тілом разом з виконаною роботою, є мірою зміни внутрішньої енергії тіла чи системи тіл.
Зміна внутрішньої енергії тіла
У разі теплопередачі обмін внутрішньою енергією між тілами відбувається за рахунок взаємодії молекул холодного тіла, які повільно рухаються, з молекулами гарячого тіла, які рухаються швидше. У результаті кінетичні енергії молекул вирівнюються і швидкості молекул холодного тіла збільшуються, а гарячого тіла — зменшуються. Наприклад, молекули металу плити, температура якої вища, ніж води в каструлі, мають в середньому більшу швидкість руху і кінетичну енергію, ніж частинки води. В результаті зіткнень швидкі молекули металу плити передають частину своєї кінетичної енергії молекулам металу каструлі, а ті в свою чергу — молекулам води, швидкість руху яких зростає.
Під час теплообміну енергія не перетворюється з однієї форми в іншу: частина внутрішньої енергії гарячого тіла передається холодному тілу.
Пригадаємо, як обчислюється зміна внутрішньої енергії під час теплообміну. У тому випадку, коли ця зміна відбувається лише завдяки теплопередачі, на основі закону збереження енергії можна твердити, що кількість теплоти поглинутої чи виділеної в розглядуваному процесі, дорівнює зміні внутрішньої енергії тіла: ![]() . Під час нагрівання чи охолодження тіла кількість переданої теплоти
. Під час нагрівання чи охолодження тіла кількість переданої теплоти ![]() прямо пропорційна масі тіла m і зміні його температури
прямо пропорційна масі тіла m і зміні його температури ![]() , тобто
, тобто
![]() .
.
Під час остигання тіла його кінцева температура ![]() менша за початкову і кількість теплоти, яку тіло віддає, від’ємна.
менша за початкову і кількість теплоти, яку тіло віддає, від’ємна.
Коефіцієнт пропорційності с характеризує залежність зміни внутрішньої енергії тіла в процесі його нагрівання або охолодження від речовини і називається питомою теплоємністю речовини.
Питома теплоємність — це кількість теплоти, яку треба надати 1кг речовини, щоб змінити її температуру на 1 К.
Одиниця питомої теплоємності — ![]() . Різним речовинам потрібна неоднакова кількість теплоти, щоб підвищити температуру 1 кг речовини на 1 К. Так, питома теплоємність води 4190 Дж/(кг·К), міді 380 Дж/(кг·К), а чавуну 460 Дж/(кг·К).
. Різним речовинам потрібна неоднакова кількість теплоти, щоб підвищити температуру 1 кг речовини на 1 К. Так, питома теплоємність води 4190 Дж/(кг·К), міді 380 Дж/(кг·К), а чавуну 460 Дж/(кг·К).
Питома теплоємність речовини не є її однозначною характеристикою. Залежно від умов, за яких здійснюється теплопередача, однакова кількість теплоти, передана тілу, може викликати різні зміни його внутрішньої енергії і, отже, температури. В таблицях звичайно наводяться дані про питому теплоємність речовини за умови постійного об’єму тіла, тобто за умови рівності нулю роботи зовнішніх сил після зміни об’єму тіла.
Зверніть увагу, що кількість теплоти — це не внутрішня енергія тіла; вона дорівнює зміні внутрішньої енергії під час теплообміну. Не можна говорити, що тіло містить таку-то кількість теплоти, в той же час тіло має певну внутрішню енергію.
Пригадаємо, як можна обчислити зміну внутрішньої енергії під час плавлення і тверднення тіла. Як ви знаєте, плавлення кристалічних тіл відбувається за цілком певної температури. Так, лід тане (якщо атмосферний тиск нормальний) за 0 °С, свинець плавиться за 327 °С, залізо — за 1530 °С тощо. Щоб розплавити тверде кристалічне тіло, йому треба надати ззовні певну кількість теплоти. Перед початком плавлення передана тілу кількість теплоти (![]() ) йде на його нагрівання до температури плавлення. В міру нагрівання середня енергія молекул тіла зростає. В основному це відбувається завдяки зростанню середньої кінетичної енергії частинок, однак і їх потенціальна енергія також зростає, оскільки з підвищенням температури збільшуються відстані між молекулами. Це спричиняє послаблення сил притягання між частинками, які утворюють кристал. За високої температури ці сили зменшуються настільки, що починає руйнуватися кристалічна решітка — відбувається перехід речовини в рідкий стан. Після досягнення температури плавлення вся підведена до тіла енергія йде на збільшення потенціальної енергії молекул і подолання зв’язків між ними, а їх кінетична енергія (отже, і температура тіла, яке плавиться) залишається незмінною.
) йде на його нагрівання до температури плавлення. В міру нагрівання середня енергія молекул тіла зростає. В основному це відбувається завдяки зростанню середньої кінетичної енергії частинок, однак і їх потенціальна енергія також зростає, оскільки з підвищенням температури збільшуються відстані між молекулами. Це спричиняє послаблення сил притягання між частинками, які утворюють кристал. За високої температури ці сили зменшуються настільки, що починає руйнуватися кристалічна решітка — відбувається перехід речовини в рідкий стан. Після досягнення температури плавлення вся підведена до тіла енергія йде на збільшення потенціальної енергії молекул і подолання зв’язків між ними, а їх кінетична енергія (отже, і температура тіла, яке плавиться) залишається незмінною.
Кількість теплоти ![]() , необхідну для перетворення 1 кг кристалічної речовини за температури плавлення в рідину за тієї самої температури, називають питомою теплотою плавлення цієї речовини. Тверднучи, 1 кг речовини віддає навколишньому середовищу таку саму кількість теплоти
, необхідну для перетворення 1 кг кристалічної речовини за температури плавлення в рідину за тієї самої температури, називають питомою теплотою плавлення цієї речовини. Тверднучи, 1 кг речовини віддає навколишньому середовищу таку саму кількість теплоти ![]() .
.
Якщо для плавлення 1 кг речовини йому треба надати кількість теплоти ![]() , то для плавлення m кг потрібно:
, то для плавлення m кг потрібно:
![]() .
.
Така сама кількість теплоти виділиться під час тверднення (кристалізації) m кг речовини.
Після повного переходу кристалічної речовини в рідину подальше надходження енергії витрачається на нагрівання утвореної рідини від температури плавлення Тпл до якоїсь температури Т2:
![]() .
.
Це зрозуміло, оскільки після руйнування кристалічної решітки надана кількість теплоти йде на збільшення кінетичної енергії молекул.
Задача. У плавильну піч завантажили 2000 кг чавуну, взятого за температури 20 °С. Яку кількість теплоти треба витратити на його плавлення? Скільки льоду, взятого за 0 °С, можна було б розплавити за рахунок цієї кількості теплоти? Питома теплота плавлення чавуну 1,4·105Дж/кг, питома теплоємність чавуну 0,46·103 Дж/(кг·К), температура його плавлення 1150 °С.
Розв’язання. Надана чавуну енергія йде на його нагрівання до температури плавлення і на плавлення, тобто
![]() ;
; ![]() .
.
За рахунок цієї кількості теплоти можна розплавити льоду
![]() ;
; ![]() .
.
Процеси плавлення і тверднення речовини широко використовують у техніці. На них ґрунтуються ливарне виробництво, виготовлення різних сплавів. В останні роки опрацьовано технологію виливання виробів з пластмас і каменю (з плавленого каменю виготовляють станини машин, труби тощо).
Можна обчислити зміну внутрішньої енергії речовини під час її випаровування чи конденсації. Для перетворення 1 кг рідини в пару за сталої температури треба надати їй кількість теплоти, що дорівнює питомій теплоті пароутворення. Позначають цю величину літерою r і вимірюють у джоулях на кілограм (Дж/кг). Для перетворення m кг рідини в пару треба затратити кількість теплоти
![]()
Під час конденсації пари в рідину виділяється така сама кількість теплоти.
Дуже велика питома теплота пароутворення води: 2,256×106 Дж/кг за температури 100 °С. В інших рідин (спирт, ефір, ртуть, гас тощо) питома теплота пароутворення менша в 3 – 10 раз.
Перетворення рідини в пару за сталої температури не приводить до збільшення кінетичної енергії молекул, але супроводжується збільшенням потенціальної енергії взаємодії молекул речовини. Адже середня відстань між молекулами газу в багато разів більша, ніж між молекулами рідини.
Внутрішня енергія тіл може змінюватися не лише під час теплообміну між ними, айв процесі виконання цими тілами (або над ними) механічної роботи, неважко переконатися на прикладах.
Так, у процесі виконання роботи на металообробних (токарних, свердлильних, фрезерних, шліфувальних тощо) верстатах нагріваються різальний інструмент, а також деталь і стружка, що свідчить про збільшення їх внутрішньої енергії.
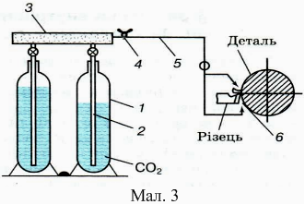
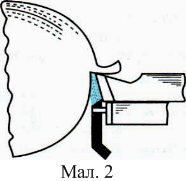
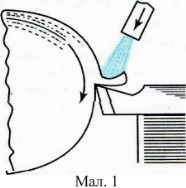 У сучасних швидкорізальних верстатах нагрівання інструменту настільки велике, що для його охолодження потрібні спеціальні заходи. Наприклад, подають до місця різання струмину рідини (мал. 1), яка, стикаючись з інструментом, різко знижує його температуру. В останні роки винайшли ефективніший спосіб охолодження такого інструменту, який ґрунтується на зміні внутрішньої енергії рідини в результаті її випаровування, тобто на використанні великої питомої теплоти пароутворення. При цьому способі охолоджувальна рідина розпиляється потоком повітря і подається безпосередньо в зону різання (мал. 2); випаровуючись, вона сильно охолоджує інструмент. Крім рідини, для охолодження різального інструменту використовують також гази (азот, охолоджене стиснуте повітря тощо); найчастіше застосовують вуглекислий газ. Рідка вуглекислота, яка перебуває в балоні 1 (мал. 3) під великим тиском (до 60 атм), подається з нього по сифонній трубі 2 і через кран 4, трубку 5 і спеціальну насадку 6 потрапляє в зону різання одночасно на передню і задню грані інструмента.
У сучасних швидкорізальних верстатах нагрівання інструменту настільки велике, що для його охолодження потрібні спеціальні заходи. Наприклад, подають до місця різання струмину рідини (мал. 1), яка, стикаючись з інструментом, різко знижує його температуру. В останні роки винайшли ефективніший спосіб охолодження такого інструменту, який ґрунтується на зміні внутрішньої енергії рідини в результаті її випаровування, тобто на використанні великої питомої теплоти пароутворення. При цьому способі охолоджувальна рідина розпиляється потоком повітря і подається безпосередньо в зону різання (мал. 2); випаровуючись, вона сильно охолоджує інструмент. Крім рідини, для охолодження різального інструменту використовують також гази (азот, охолоджене стиснуте повітря тощо); найчастіше застосовують вуглекислий газ. Рідка вуглекислота, яка перебуває в балоні 1 (мал. 3) під великим тиском (до 60 атм), подається з нього по сифонній трубі 2 і через кран 4, трубку 5 і спеціальну насадку 6 потрапляє в зону різання одночасно на передню і задню грані інструмента.
Переходячи з рідкого в газоподібний стан, вуглекислота сильно охолоджується (до –40°С). В камері 3 вуглекислий газ попередньо осушують. Це дає змогу успішно застосовувати такий вуглекислий газ під час фрезерування важкооброблюваних матеріалів (титану, нікелю, хрому тощо).
Зміна внутрішньої енергії під час виконання роботи є причиною нагрівання тіл, які труться, причому чим більша робота виконується, тим сильніше змінюється внутрішня енергія тіла і тим більше воно нагрівається. При недостатньому змащенні робота сил тертя може бути такою великою, що внаслідок нагрівання плавляться підшипники (наприклад, корінні і шатунні колінчастого вала тракторного чи автомобільного двигуна).
Здатність змінювати внутрішню енергію тіл під час виконання роботи (див. табл. 1) застосовують у техніці. Одним з прикладів є зварювання тертям. Зварювані деталі щільно притискають і потім приводять у швидке обертання одна відносно одної. В результаті виконання роботи на подолання сили тертя між деталями відбуваються розігрівання і плавлення їх поверхонь, і при стисканні вони зварюються. Цей вид зварювання застосовують для з’єднання частин валів, штоків з поршнями, виготовлення складного різального інструменту тощо.
|
Механічна робота (подолання тертя, деформація, дроблення тіл тощо) |
|
|
|
Нагрівання і охолодження |
|
|
|
Плавлення і тверднення речовин |
|
|
|
Пароутворення і конденсація |
|
|
|
Згоряння речовини |
|
|
У тому, що нагрівання тіла може відбуватися без надання йому певної кількості теплоти, а за рахунок виконання роботи, неважко переконатися і на простих дослідах. Зігніть і розігніть кілька разів мідну пластинку чи дротину, і ви виявите, що місце згину нагрілося. Вдарте кілька разів молотком по шматку свинцю, виявиться, що свинець також нагрівся.
Таким чином, внутрішня енергія тіла може змінюватися в результаті виконання роботи, причому ця зміна внутрішньої енергії завжди має дорівнювати виконаній над тілом роботі.
Перший закон термодинаміки
Внутрішня енергія тіла може бути змінена у процесі теплопередачі чи виконання роботи, причому обидва ці процеси можуть відбуватись і одночасно.
Наприклад, газ у циліндрі під поршнем може нагріватися за рахунок передачі йому певної кількості теплоти, і одночасно виконуватися робота на його розширення і стискання. З попередніх курсів фізики ви знаєте, що всі процеси у природі підлягають закону збереження і перетворення енергії. Природно, що і процеси зміни внутрішньої енергії тіл також відбуваються згідно з цим законом. Нагадаємо, що за законом збереження і перетворення енергії при всіх процесах, які відбуваються в природі, енергія не виникає і не зникає, а лише перетворюється в рівних кількостях із одного виду в інший. (Відповідно до закону збереження і перетворення енергії зміна внутрішньої енергії системи ![]() дорівнює сумі наданої їй кількості теплоти Q і роботи, виконаної над системою зовнішніми силами A':
дорівнює сумі наданої їй кількості теплоти Q і роботи, виконаної над системою зовнішніми силами A':
![]() . (
. (![]() )
)
Це твердження прийнято називати першим законом (началом) термодинаміки. У формулі під А' розуміють роботу, яка виконується над системою зовнішніми силами (її вважають додатною величиною). Але можна розглядати і роботу А, виконану системою над зовнішніми тілами. Тоді її записують з від’ємним знаком, і рівняння (![]() ) набуває вигляду:
) набуває вигляду:
![]() або
або ![]() . (
. (![]() )
)
Останнє співвідношення є іншою формою запису першого закону термодинаміки. Воно показує, що підведена до системи кількість теплоти ![]() частково йде на збільшення її внутрішньої енергії
частково йде на збільшення її внутрішньої енергії ![]() і частково на виконання системою роботи А над зовнішніми тілами.
і частково на виконання системою роботи А над зовнішніми тілами.
Суть першого закону термодинаміки полягає в тому, що внутрішня енергія тіла, яке взаємодіє з іншими тілами, змінюється за рахунок двох процесів — теплообміну і роботи зовнішніх сил чи роботи над зовнішніми тілами. Будь-яке збільшення внутрішньої енергії тіла обов’язково супроводжується зменшенням в рівній кількісній мірі енергії взаємодіючих з ним тіл, а зменшення внутрішньої енергії тіла — відповідним збільшенням енергії взаємодіючих з ним тіл. Внутрішня енергія системи, ізольованої від будь-яких взаємодій із зовнішнім середовищем, не змінюється за будь-яких взаємодій всередині системи.
Історично встановлення цього закону було пов’язане з невдачами щодо створення машини, яка б нескінченно довго виконувала роботу без надходження теплоти ззовні. В термодинаміці таку машину називають «вічним» двигуном першого роду.
Якщо до системи не надходить теплота (![]() ), то робота А згідно з (
), то робота А згідно з (![]() ) може виконуватися лише за рахунок зменшення внутрішньої енергії
) може виконуватися лише за рахунок зменшення внутрішньої енергії ![]() . Після того як запас внутрішньої енергії буде вичерпано, двигун припинить свою роботу. Отже, неможливо побудувати «вічний» двигун першого роду, оскільки неможливо нескінченно довго виконувати роботу за рахунок скінченного значення внутрішньої енергії якоїсь системи (машини).
. Після того як запас внутрішньої енергії буде вичерпано, двигун припинить свою роботу. Отже, неможливо побудувати «вічний» двигун першого роду, оскільки неможливо нескінченно довго виконувати роботу за рахунок скінченного значення внутрішньої енергії якоїсь системи (машини).
Будь-яка машина може виконувати роботу над зовнішніми тілами лише за рахунок одержання ззовні певної кількості теплоти або зменшення її внутрішньої енергії.
Нагріваючи тіло за рахунок теплопередачі, ми збільшуємо його внутрішню енергію. Внаслідок його розширення під час нагрівання згідно з першим законом термодинаміки виконується робота проти сил, які перешкоджають розширенню (такими силами є сили зовнішнього тиску і сили притягання між молекулами речовини). На виконання цієї роботи потрібна додаткова кількість теплоти.
У випадку твердих тіл і рідин теплове розширення завжди мізерно мале, на нього йде незначна додаткова енергія, якою можна знехтувати. Тому згідно з першим законом термодинаміки під час нагрівання твердих тіл і рідин за рахунок теплопередачі без виконання роботи вся кількість теплоти витрачається лише на зміну їх внутрішньої енергії.
У випадку газів роботою, яка виконується газом під час розширення, нехтувати не можна.
Застосування першого закону термодинаміки для ізопроцесів
 Розглянемо застосування першого закону термодинаміки до процесів зміни стану ідеального газу.
Розглянемо застосування першого закону термодинаміки до процесів зміни стану ідеального газу.
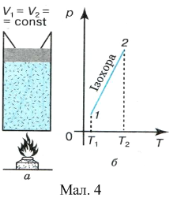
Ізохорний процес. Нехай ідеальний газ міститься в циліндрі із закріпленим поршнем
(мал. 4, а). Надамо газові певну кількість теплоти. Оскільки в цьому випадку його об’єм залишається сталим (![]() ; мал.4, б), робота розширення дорівнює нулеві і формула першого закону термодинаміки набуває вигляду:
; мал.4, б), робота розширення дорівнює нулеві і формула першого закону термодинаміки набуває вигляду:
![]() .
.
Якщо газ нагрівається, то ![]() і
і ![]() — внутрішня енергія газу зростає. Під час охолодження газу його внутрішня енергія зменшується.
— внутрішня енергія газу зростає. Під час охолодження газу його внутрішня енергія зменшується.
Таким чином, у разі ізохорної зміни стану газу вся кількість підведеної до нього теплоти йде на зміну внутрішньої енергії газу.
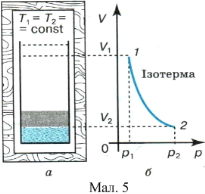
Ізотермічний процес. Помістимо газ у циліндрі з легкорухомим поршнем в термостат (мал. 5, а), в якому підтримується стала температура. Надамо газові можливість розширятися, але щоб його температура не знизилася, він повинен дістати від термостата кількість теплоти. Оскільки внутрішня енергія ідеального газу не залежить від об’єму, то у разі ізотермічної зміни стану його внутрішня енергія залишається незмінною (![]() ), і рівняння першого закону термодинаміки записується так:
), і рівняння першого закону термодинаміки записується так:
![]() .
.
З цього виразу випливає, що під час ізотермічного процесу вся підведена до газу кількість теплоти витрачається на виконання газом роботи. У процесі ізотермічного розширення ідеальний газ виконує роботу проти зовнішніх сил за рахунок набутої кількості теплоти; під час ізотермічного стискання зовнішні сили виконують роботу, а газ віддає навколишньому середовищу еквівалентну кількість теплоти.
Нагадаємо, що робота газу під час ізотермічного процесу чисельно дорівнює площі (мал. 5, б), обмеженій ізотермою і вертикальними прямими для початкового р1 і кінцевого р2 станів газу.
Ізобарний процес. Для цього нагріватимемо газ у циліндрі з поршнем, який вільно переміщається у ньому (мал. 6, а). Надана газу кількість теплоти частково переходить у внутрішню енергію системи, а частково витрачається на виконання роботи — підняття поршня:
![]() .
.
 У разі ізобарного розширення кількість підведеної до газу теплоти більша за виконану ним роботу на величину, яка дорівнює зростанню його внутрішньої енергії. Робота газу під час ізобарного процесу чисельно дорівнює площі прямокутника (мал. 6, б), обмеженого ізобарою, віссю об’ємів та ізохорами, які відповідають початковому
У разі ізобарного розширення кількість підведеної до газу теплоти більша за виконану ним роботу на величину, яка дорівнює зростанню його внутрішньої енергії. Робота газу під час ізобарного процесу чисельно дорівнює площі прямокутника (мал. 6, б), обмеженого ізобарою, віссю об’ємів та ізохорами, які відповідають початковому ![]() і кінцевому
і кінцевому ![]() станам газу.
станам газу. 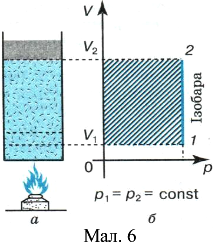
Рівняння теплового балансу для теплообміну
Задача 1. Яку кількість теплоти треба надати 5 кг льоду, взятого за температури –10 °С, щоб його розплавити, а одержану воду нагріти до 100°С і випарити? Питома теплоємність льоду становить 2,1·103 Дж/(кг·К), води 4,2·103 Дж/(кг·К), питома теплота плавлення льоду 3,35·105 Дж/кг, питома теплота пароутворення води r = 22,6·105 Дж/кг.
Розв’язання. Надана в розглядуваному випадку кількість теплоти має бути витрачена на зміну внутрішньої енергії:
льоду під час нагрівання його до точки плавлення:
![]() ;
;
льоду під час його плавлення:
![]() ;
;
води, що утворилася з льоду, для нагрівання її до 100 °С:
![]() ;
;
води під час випаровування:
![]() .
.
Отже, повна кількість теплоти
![]() ;
;
![]() .
.
Нарешті, пригадаємо, як обчислюється зміна внутрішньої енергії під час згоряння речовини. Види палива характеризуються питомою теплотою згоряння, тобто кількістю теплоти, яка виділяється у разі повного згоряння 1 кг палива. Позначають цю величину літерою q і вимірюють у джоулях на кілограм (Дж/кг). Наприклад, теплота згоряння природного газу 4,4·107 Дж/кг, бензину 4,6·107 Дж/кг, водню 1,4·108 Дж/кг. Щоб обчислити кількість теплоти, яка виділяється під час згоряння будь-якої маси палива, треба питому теплоту згоряння q помножити на масу m:
![]() .
.
Зауважимо, що потребу в паливі часто виражають в тоннах умовного палива, питому теплоту згоряння якого прийнято рівною 29,3·106 Дж/кг.
Задача 2. Мартенівська піч працює на природному газі. Скільки газу треба спалити для виплавлення 50 т сталі, якщо ККД печі 40 % ? Початкова температура сталі 20 °С, її питома теплоємність 0,46·103 Дж/(кг·К), питома теплота плавлення 2,7·105 Дж/кг, температура плавлення 1500 °С, питома теплота згоряння газу 4,4·107 Дж/кг.
Розв’язання. Щоб нагріти до температури 1500 °С і розплавити сталь, їй треба надати кількість теплоти
![]() .
.
Однак під час згоряння газу лише 40 % виділеної кількості теплоти m2q йде на нагрівання і плавлення сталі. Тому
![]() ,
,
звідси
![]() ,
,
![]() .
.
Якщо в теплообміні беруть участь кілька тіл, то кількість теплоти, що її віддають тіла, внутрішня енергія яких зменшується, має дорівнювати кількості теплоти, одержаної тілами, внутрішня енергія яких збільшується. Ця рівність становить рівняння теплового балансу, на його основі розв’язується багато практичних задач.
Задача 3. Для загартування стальний лист, маса якого 240 кг, нагріли до температури 850 °С і опустили у ванну з маслом. Визначити кількість масла у ванні, якщо початкова температура його була 50 °С, а після занурення в нього нагрітого листа піднялася до 70 °С. Питома теплоємність сталі 0,46·103(Дж/кг·К), масла 1,7·103(Дж/кг·К).
Розв’язання. В теплообміні беруть участь два тіла: масло і стальний лист. Отже, кількість теплоти, що віддає стальний лист, дорівнює
![]() ,
,
а масло дістає
![]() ,
,
Складемо рівняння теплового балансу:
![]() , або
, або ![]() ,
,
звідси
![]() ;
; ![]() .
.
Адіабатний процес
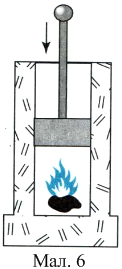 Вам, напевне, доводилося накачувати насосом велосипедну шину або волейбольний м’яч і ви спостерігали, що насос при цьому сильно нагрівається. Таке підвищення температури відбувається не внаслідок тертя поршня об стінки насоса, яке дуже мале, а завдяки нагріванню повітря від стискання. Явище нагрівання газу при його швидкому стисканні можна спостерігати на досліді з приладом «Повітряне кресало» (мал. 6). На дно товстостінного скляного циліндра з поршнем кладуть невеликий шматок піроксилінової вати або вати, змоченої ефіром, і швидко натискують на поршень. Вата спалахує. Причина її загоряння — різке підвищення температури повітря під час швидкого стискання його поршнем.
Вам, напевне, доводилося накачувати насосом велосипедну шину або волейбольний м’яч і ви спостерігали, що насос при цьому сильно нагрівається. Таке підвищення температури відбувається не внаслідок тертя поршня об стінки насоса, яке дуже мале, а завдяки нагріванню повітря від стискання. Явище нагрівання газу при його швидкому стисканні можна спостерігати на досліді з приладом «Повітряне кресало» (мал. 6). На дно товстостінного скляного циліндра з поршнем кладуть невеликий шматок піроксилінової вати або вати, змоченої ефіром, і швидко натискують на поршень. Вата спалахує. Причина її загоряння — різке підвищення температури повітря під час швидкого стискання його поршнем.
 Отже, у разі стискання газу його внутрішня енергія зростає за рахунок роботи зовнішньої сили, яка виконує стискання. При розширенні ж газу без підведення до нього енергії ззовні його внутрішня енергія зменшується. Це можна виявити на такому досліді. У велику скляну посудину (мал.7) наливають трохи води, вводять дим і накачують повітря. При цьому вода з посудини зникає (випаровується), що свідчить про підвищення температури повітря в посудині. Коли тиск у посудині стане достатньо великим, корок викидається, повітря, швидко розширюючись, виходить з неї, внаслідок чого утворюється густий туман, що свідчить про охолодження повітря під час розширення. Розширюючись, газ виконує роботу з переміщення частинок за рахунок зменшення внутрішньої енергії.
Отже, у разі стискання газу його внутрішня енергія зростає за рахунок роботи зовнішньої сили, яка виконує стискання. При розширенні ж газу без підведення до нього енергії ззовні його внутрішня енергія зменшується. Це можна виявити на такому досліді. У велику скляну посудину (мал.7) наливають трохи води, вводять дим і накачують повітря. При цьому вода з посудини зникає (випаровується), що свідчить про підвищення температури повітря в посудині. Коли тиск у посудині стане достатньо великим, корок викидається, повітря, швидко розширюючись, виходить з неї, внаслідок чого утворюється густий туман, що свідчить про охолодження повітря під час розширення. Розширюючись, газ виконує роботу з переміщення частинок за рахунок зменшення внутрішньої енергії.
У розглянутих прикладах теплообміном між газом і навколишнім середовищем можна знехтувати, оскільки зміна його стану відбувається дуже швидко.
Отже, під час стискання газу без теплообміну з навколишнім середовищем його внутрішня енергія збільшується, під час розширення– зменшується. Цей висновок випливає з першого закону термодинаміки:
Оскільки теплообмін відсутній, ![]() і, отже,
і, отже,
![]() .
.
Це означає, що у разі розширення газу виконується додатна робота за рахунок внутрішньої енергії і це приводить до охолодження газу. Під час стискання газу виконується від’ємна робота, внутрішня енергія газу зростає, він нагрівається.
Процес зміни стану газу, який відбувається без теплообміну з навколишніми тілами, називають адіабатним.
Повністю усунути теплообмін газу з навколишніми тілами неможливо, оскільки в природі не існує речовин, зовсім позбавлених теплопровідності. Але можна стиснути чи розширити газ так, щоб теплообмін був незначним і ним можна було знехтувати. Тому за малий інтервал часу можна вважати ![]() і розглядати ці процеси як адіабатні.
і розглядати ці процеси як адіабатні.
Нагрівання повітря від швидкого стискання використовується в дизельних двигунах для запалювання пальної суміші. В циліндри цих двигунів засмоктується атмосферне повітря (а не пальна суміш, як у двигунах внутрішнього згоряння). Від швидкого стискання температура повітря підвищується і до кінця стискання перевищує температуру запалювання пального. В цей момент у циліндр за допомогою спеціальної форсунки вприскують пальне, яке дрібно розпилюється; під час зіткнення з розжареним повітрям воно загоряється.
Коли працюють потужні компресори, які стискають повітря, температура повітря настільки підвищується, що доводиться вдаватися до спеціальної системи охолодження циліндрів.
Охолодження газу під час адіабатного розширення відбувається у величезних масштабах в атмосфері Землі. Нагріте повітря піднімається вгору і розширюється, оскільки атмосферний тиск зменшується з висотою. Це розширення супроводжується значним охолодженням. У результаті пара конденсується і утворюються хмари.
Задача 1. Під час адіабатного розширення газ виконав роботу
А = 500 Дж. Чому дорівнює зміна його внутрішньої енергії? Як змінилася температура газу?
Розв’язання. В адіабатному процесі ![]() .
.
Отже, ![]() Дж. Знак мінус означає, що внутрішня енергія газу зменшилась. Отже, температура газу знизилась.
Дж. Знак мінус означає, що внутрішня енергія газу зменшилась. Отже, температура газу знизилась.
Задача 2. У разі стискання газу в циліндрі зовнішня сила, яка діє на поршень, виконує роботу А = 300 Дж. Чому дорівнює зміна внутрішньої енергії газу, якщо завдяки теплопровідності циліндра він віддає в навколишнє середовище кількість теплоти, рівну Q = 20 Дж?
Розв’язання. Згідно з першим законом термодинаміки ![]() , або
, або ![]() . Оскільки газ віддає теплоту, то Q — величина від’ємна:
. Оскільки газ віддає теплоту, то Q — величина від’ємна: ![]() . Робота сили, з якою газ діє на поршень під час стискання, від’ємна: A =
. Робота сили, з якою газ діє на поршень під час стискання, від’ємна: A = ![]() 300 Дж. Отже,
300 Дж. Отже, ![]() .
.
1


про публікацію авторської розробки
Додати розробку
