Опорний конспект з теми: " Лужно-земельні метали. Сполуки лужно-земельних металів."
II група головна підгрупа
2s2 )) Берилій Ве зростає атомний радіус;
3s2))) Магній Mg üметалічні та
4s2)))) Кальцій Ca відновні
6s
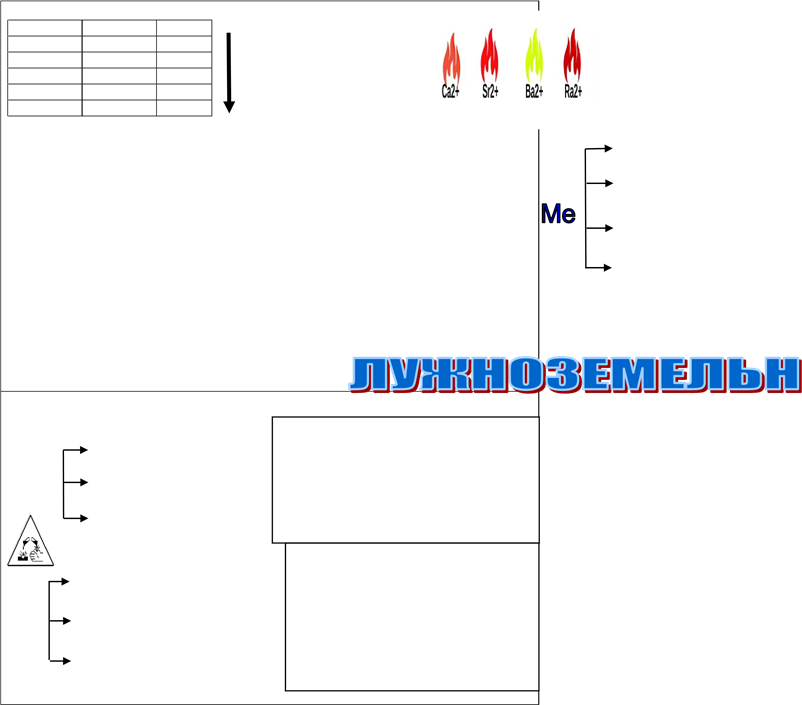 5s222)))))))))))))))))) СтронційРадійБарій BaRaSr0 - 2ê → Мезменшується+2 ü електронегативнвластивості: ість
5s222)))))))))))))))))) СтронційРадійБарій BaRaSr0 - 2ê → Мезменшується+2 ü електронегативнвластивості: ість
7s
Валентність – ΙI, CO =+2, Ме
Me* - nS1nP1
В природіу вигляді солей: Ca3(PO4)2-фосфорит
CaCO3 – кальцит, вапняк, крейда, 3Ca3(PO4)2 x CaF2-апатит
ісландський шпат (прозора різновидність) Mg2+ входить до складу хлорофілу
Ca2SO4· 2H2O – гіпс Добування:
2Ca2SO4 · H2O –алебастр 1. Електроліз расплаву солей CaF2
Ca(NO3)2 -норвезька селітра MgCl2 → Mg0 + Cl20↑ CaCl2 → Ca0 +Cl20↑
CaF2 -плавиковий шпат, флюорит 2. Відновленням з оксиду
CaCO3x MgCO3 -доломіт MgO + C t=2000 = Mg + CO0 ↑
MgCO3- магнезит 3. Алюмотермічним способом
MgCl2 x 6H2O -бішофіт вакуум, 11000
MgCl2 x KCl x 6H2O -карналіт 3CaO + 2Al = Al2O3 + 3Ca
3MgO x 4SiO2 x H2O - тальк
CaO x 3MgO x SiO2 -азбест
Сполуки лужноземельних металів
Оксиди- основні (ВеО-амфотерний)
Виключення MgО + H2O ≠
+ вода→ луг СаО-негашене або палене вапно
CaO + Zn = CaZnO
МеО +кислотний оксид → сіль CaO + Zn(OH)2 = CaZnO2 + H2O
CaO + 3C=CaC2+CO
+ кислота → сіль + Н2О 2MgO + 5C=Mg2C3+2CO
СaO + 5CO=CaC2+ 3CO2
Основи - луги та Ме(ОН)х↓ гідриди
МеН2 + Н2О → Ме(ОН)2 + Н2↑
+кислотний оксид →сіль+Н2О Якісна реакція на йони Ме2+
Me2+ + Na2CO3= 2Na1+ + MeCO3↓
Ме (ОН)2 + кислота → сіль + Н2О CaCaCO(OH3 )+2 +H CO2O + CO2= Ca2CO= Ca(3↓+HCO H2O3)2
1Ca(OH)2 +1Cl2= CaOCl2 + H2O
+ сіль→ нова сіль + Ме(ОН)х↓ Хлорне вапно
2Ca(OH)2 +2Cl2= Ca(OCl)2+СaCl2 +2H2O
Сa(OH)2- вапняна вода, вапняне молоко, гашене вапно
Фізичні властивості - легкі,м’які, розрізаються ножем
Металічна кристалічна ґратка: - легкоплавкі
-  електропровідні - на повітрі вкриваються оксидною плівкою
електропровідні - на повітрі вкриваються оксидною плівкою
- сріблясто-білі, зберігають під
Хімічні властивості шаром гасу
+ О2→оксид (пероксид ) MeH2 - гідрид MeCl2 - хлорид
+ неметал → сіль
MeS -сульфід
Me3N2 - нітрид
+ Н2О → луг + Н2 ↑ (! Be, Mg!) Me2C3 MeC2 - карбід
Ме3Р2 -фосфід
+ кислота → сіль + Н2 ↑ Ме(ОН)2 - гідроксид
MeSO4 - сульфат
Ме + сіль → нова сіль + новий Ме MeCO3 - карбонат
Ме + МехОу → новий МехОу + новий Ме
Жорсткість води та способи її усунення
Вода, що містить йони Кальцію Са 2+ та Магнія Mg 2+ називається жорсткою (твердою). Приклад: морська та джерельна вода.
Якщо у воді не міститься цих йонів, або їх мало, то це - м’яка вода. Приклад: дощова вода Типи жорсткості води.

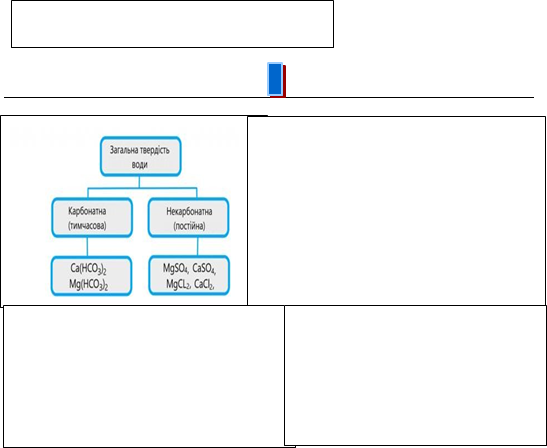 В залежності від того, які сполуки Кальцію чи Магнію знаходяться у природній воді, виділяють три види жорсткості (твердості) води: карбонатнуабо тимчасову, некарбонатнуабо постійну, загальну ( уявляє собою суму карбонатної та
В залежності від того, які сполуки Кальцію чи Магнію знаходяться у природній воді, виділяють три види жорсткості (твердості) води: карбонатнуабо тимчасову, некарбонатнуабо постійну, загальну ( уявляє собою суму карбонатної та
некарбонатної жорсткості).
Усунення карбонатної Усунення некарбонатної
1.кипятінням 1.додавання кальцинованої соди
Са2+ + 2НСО32-= СаСО3↓+ СО2 ↑ + Н2О MgSO4 +Na2CO3→ MgCO3↓ + Na2SO4 Mg2+ + 2НСО32-=MgСО3↓+ СО2 ↑ + Н2О 2.додавання вапняного молока
2. додавання кальцинованої соди MgSO4+Ca(OH)2→Mg(OH)2↓+CaSO4↓
Са(НСО3)2+Na2CO3→ CaCO3↓ + 2NaНСО3 3.додаванням натрій ортофосфату
3. за допомогою вапняного молока 3CaSO4+2Na3PO4→Ca3(PO4)2↓+3Na2SO4
Са(НСО3)2 +Ca(OH)2→ 2CaCO3↓ + 2Н2О


про публікацію авторської розробки
Додати розробку
