МОЛЕКУЛЯРНА ФІЗИКА. ОСНОВИ МКТ. ГАЗОВІ ЗАКОНИ




![ХАРАКТЕРИСТИКИ МОЛЕКУЛМаса молекули: позначення : 𝒎𝟎 одиниця виміру : [ 𝒎𝟎 ] = 1 кг ( система СІ)Маса речовини:позначення : 𝒎 одиниця виміру : [ 𝒎 ] = 1 кг ( система СІ) 𝒎 = 𝒎𝟎⋅𝑵, де 𝑵 - кількість молекул Відносна молекулярна (атомна) маса - це маса молекули (атома), виражена в а.о.м.позначення : Мr одиниця виміру : [Мr ] = 1 а.о.м. ( система СІ) 1 а.о.м. = 1,660·10-27 кг. Позначення єлементу. Назва єлементу. Порядковий номер. Відносна молекулярна (атомна) маса𝒎𝟎 = 𝑴𝒓⋅𝟏 а.о.м. Курносова Н. Ф, вчитель фізики ХЗОШ№122 ХАРАКТЕРИСТИКИ МОЛЕКУЛМаса молекули: позначення : 𝒎𝟎 одиниця виміру : [ 𝒎𝟎 ] = 1 кг ( система СІ)Маса речовини:позначення : 𝒎 одиниця виміру : [ 𝒎 ] = 1 кг ( система СІ) 𝒎 = 𝒎𝟎⋅𝑵, де 𝑵 - кількість молекул Відносна молекулярна (атомна) маса - це маса молекули (атома), виражена в а.о.м.позначення : Мr одиниця виміру : [Мr ] = 1 а.о.м. ( система СІ) 1 а.о.м. = 1,660·10-27 кг. Позначення єлементу. Назва єлементу. Порядковий номер. Відносна молекулярна (атомна) маса𝒎𝟎 = 𝑴𝒓⋅𝟏 а.о.м. Курносова Н. Ф, вчитель фізики ХЗОШ№122](/uploads/files/1149321/357535/411229_images/7.jpg)
![ХАРАКТЕРИСТИКИ МОЛЕКУЛМоля́рна ма́са — маса 1 моля речовини, тобто 6.02214076 × 1023 (Число Авогадро) структурних одиниць цієї речовини (атомів чи молекул чи йонов). позначення : M одиниця виміру : [ M ] = 1 КГМОЛЬ ( система СІ) Кількість речовини це кількість частинок ( структурних одиниць).позначення : ν одиниця виміру : [ν] = 1 моль ( система СІ) 1 моль – це кількість речовини, в якій міститься стільки ж частинок, як у 0,012 кг ізотопу Карбону 𝟏𝟐 С. Це число зветься Столою Авогадро і дорівнює : M = 𝒎𝟎⋅ 𝑵𝑨 , де 𝒎𝟎 - маса однієї молекули ( атома) ν = 𝑵𝑵𝑨 = 𝒎𝑴𝒓 , де 𝑵𝑨 - стала Авогадро 𝑵𝑨 = 6,02 · 𝟏𝟎𝟐𝟑 𝟏моль ВАЖЛИВО ПАМ′ЯТАТИ ! РІВНА КІЛЬКІСТЬ ЧАСТИНОК , АЛЕ РІЗНА МАСА M = 𝟏𝟎𝟑⋅ 𝑴𝒓 - зв’язок між відносною та молярною масами 1 моль6,02· 𝟏𝟎𝟐𝟑структурниходиниць Курносова Н. Ф, вчитель фізики ХЗОШ№122 ХАРАКТЕРИСТИКИ МОЛЕКУЛМоля́рна ма́са — маса 1 моля речовини, тобто 6.02214076 × 1023 (Число Авогадро) структурних одиниць цієї речовини (атомів чи молекул чи йонов). позначення : M одиниця виміру : [ M ] = 1 КГМОЛЬ ( система СІ) Кількість речовини це кількість частинок ( структурних одиниць).позначення : ν одиниця виміру : [ν] = 1 моль ( система СІ) 1 моль – це кількість речовини, в якій міститься стільки ж частинок, як у 0,012 кг ізотопу Карбону 𝟏𝟐 С. Це число зветься Столою Авогадро і дорівнює : M = 𝒎𝟎⋅ 𝑵𝑨 , де 𝒎𝟎 - маса однієї молекули ( атома) ν = 𝑵𝑵𝑨 = 𝒎𝑴𝒓 , де 𝑵𝑨 - стала Авогадро 𝑵𝑨 = 6,02 · 𝟏𝟎𝟐𝟑 𝟏моль ВАЖЛИВО ПАМ′ЯТАТИ ! РІВНА КІЛЬКІСТЬ ЧАСТИНОК , АЛЕ РІЗНА МАСА M = 𝟏𝟎𝟑⋅ 𝑴𝒓 - зв’язок між відносною та молярною масами 1 моль6,02· 𝟏𝟎𝟐𝟑структурниходиниць Курносова Н. Ф, вчитель фізики ХЗОШ№122](/uploads/files/1149321/357535/411229_images/8.jpg)








4. Теплопередача (теплообмін) – це. Що вже знаємо?(БЛІЦ) 1. Теплові явища - це всі фізичні процеси, що відбуваються з матеріальними тілами під впливом температурипроцес зміни внутрішньої енергії тіла або частин тіла без виконання роботи.5. Скільки видів теплопередачі ви знаєте?36. який вид теплопередачі на малюнку під номером 1?Теплопровідність - передача теплоти від більш нагрітої до менш нагрітої частини тіла внаслідок теплового руху його частинок. Конвекція - перенесення тепла в рідинах, газах або сипких середовищах потоками самої речовини (неважливо, вимушено або мимоволі)Випромінювання - передача енергії у вигляді хвиль або частинок через вакум або у товщі середовища.7. який вид теплопередачі на малюнку під номером 2 ?8. який вид теплопередачі на малюнку під номером 3 ?2. Внутрішня енергія тіла — цесума кінетичної енергії теплового руху частинок, із яких складається тіло, і потенціальної енергії їхньої взаємодії. 3. Способи зміни внутрішньої енергіїТеплопередача, механічна робота, хімічна реакція. Курносова Н. Ф, вчитель фізики ХЗОШ№122
Молекулярна фізика – це розділ, який вивчає фізичні властивості і агрегатні стани речовин в залежності від їх молекулярної будови і сил взаємодії між молекулами. Вона базується на трьох основних положеннях молекулярнокінетичної теоріїМОЛЕКУЛЯРНА ФІЗИКА. Молекулярно-кінетичною теорією (МКТ) називають теорію, яка пояснює будову та властивості тіл на основі закономірностей руху та взаємодії атомів і молекул. Курносова Н. Ф, вчитель фізики ХЗОШ№122
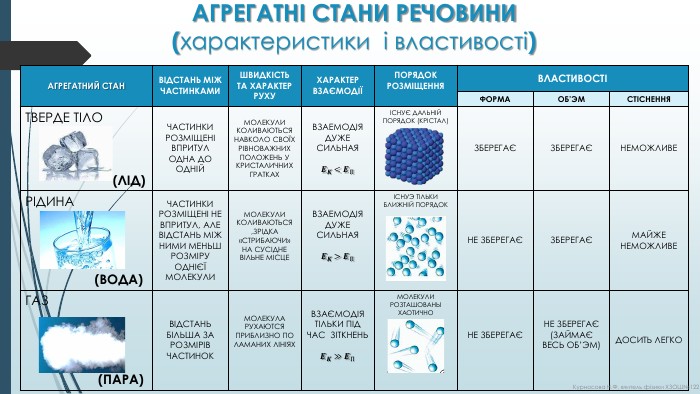
АГРЕГАТНІ СТАНИ РЕЧОВИНИ (характеристики і властивості){72833802-FEF1-4 C79-8 D5 D-14 CF1 EAF98 D9}АГРЕГАТНИЙ СТАНВІДСТАНЬ МІЖ ЧАСТИНКАМИШВИДКІСТЬ ТА ХАРАКТЕР РУХУХАРАКТЕР ВЗАЄМОДІЇПОРЯДОК РОЗМІЩЕННЯВЛАСТИВОСТІФОРМАОБ’ЭМСТІСНЕННЯТВЕРДЕ ТІЛО (ЛІД)ЧАСТИНКИРОЗМІЩЕНІ ВПРИТУЛ ОДНА ДО ОДНІЙМОЛЕКУЛИ КОЛИВАЮТЬСЯ НАВКОЛО СВОЇХ РІВНОВАЖНИХ ПОЛОЖЕНЬ У КРИСТАЛИЧНИХ ГРАТКАХВЗАЕМОДІЯ ДУЖЕ СИЛЬНАЯ𝑬𝑲<𝑬ПІСНУЄ ДАЛЬНІЙ ПОРЯДОК (КРІСТАЛ)ЗБЕРЕГАЄЗБЕРЕГАЄНЕМОЖЛИВЕРІДИНА (ВОДА)ЧАСТИНКИ РОЗМІЩЕНІ НЕ ВПРИТУЛ, АЛЕ ВІДСТАНЬ МІЖ НИМИ МЕНЬШ РОЗМІРУ ОДНІЄЇ МОЛЕКУЛИМОЛЕКУЛИ КОЛИВАЮТЬСЯ ,ЗРІДКА «СТРИБАЮЧИ» НА СУСІДНЕ ВІЛЬНЕ МІСЦЕВЗАЕМОДІЯ ДУЖЕ СИЛЬНАЯ𝑬𝑲>𝑬ПІСНУЭ ТІЛЬКИ БЛИЖНІЙ ПОРЯДОКНЕ ЗБЕРЕГАЄЗБЕРЕГАЄМАЙЖЕ НЕМОЖЛИВЕГАЗ (ПАРА)ВІДСТАНЬ БІЛЬША ЗА РОЗМІРІВ ЧАСТИНОКМОЛЕКУЛА РУХАЮТСЯ ПРИБЛИЗНО ПО ЛАМАНИХ ЛІНІЯХВЗАЄМОДІЯ ТІЛЬКИ ПІД ЧАС ЗІТКНЕНЬ𝑬𝑲≫𝑬ПМОЛЕКУЛИ РОЗТАШОВАНЫ ХАОТИЧНОНЕ ЗБЕРЕГАЄНЕ ЗБЕРЕГАЄ(ЗАЙМАЄ ВЕСЬ ОБ’ЭМ)ДОСИТЬ ЛЕГКО{72833802-FEF1-4 C79-8 D5 D-14 CF1 EAF98 D9}АГРЕГАТНИЙ СТАНВІДСТАНЬ МІЖ ЧАСТИНКАМИШВИДКІСТЬ ТА ХАРАКТЕР РУХУХАРАКТЕР ВЗАЄМОДІЇПОРЯДОК РОЗМІЩЕННЯВЛАСТИВОСТІФОРМАОБ’ЭМСТІСНЕННЯТВЕРДЕ ТІЛО (ЛІД)ЧАСТИНКИРОЗМІЩЕНІ ВПРИТУЛ ОДНА ДО ОДНІЙМОЛЕКУЛИ КОЛИВАЮТЬСЯ НАВКОЛО СВОЇХ РІВНОВАЖНИХ ПОЛОЖЕНЬ У КРИСТАЛИЧНИХ ГРАТКАХІСНУЄ ДАЛЬНІЙ ПОРЯДОК (КРІСТАЛ)ЗБЕРЕГАЄЗБЕРЕГАЄНЕМОЖЛИВЕРІДИНА (ВОДА)ЧАСТИНКИ РОЗМІЩЕНІ НЕ ВПРИТУЛ, АЛЕ ВІДСТАНЬ МІЖ НИМИ МЕНЬШ РОЗМІРУ ОДНІЄЇ МОЛЕКУЛИМОЛЕКУЛИ КОЛИВАЮТЬСЯ ,ЗРІДКА «СТРИБАЮЧИ» НА СУСІДНЕ ВІЛЬНЕ МІСЦЕІСНУЭ ТІЛЬКИ БЛИЖНІЙ ПОРЯДОКНЕ ЗБЕРЕГАЄЗБЕРЕГАЄМАЙЖЕ НЕМОЖЛИВЕГАЗ (ПАРА)ВІДСТАНЬ БІЛЬША ЗА РОЗМІРІВ ЧАСТИНОКМОЛЕКУЛА РУХАЮТСЯ ПРИБЛИЗНО ПО ЛАМАНИХ ЛІНІЯХМОЛЕКУЛИ РОЗТАШОВАНЫ ХАОТИЧНОНЕ ЗБЕРЕГАЄНЕ ЗБЕРЕГАЄ(ЗАЙМАЄ ВЕСЬ ОБ’ЭМ)ДОСИТЬ ЛЕГКОКурносова Н. Ф, вчитель фізики ХЗОШ№122
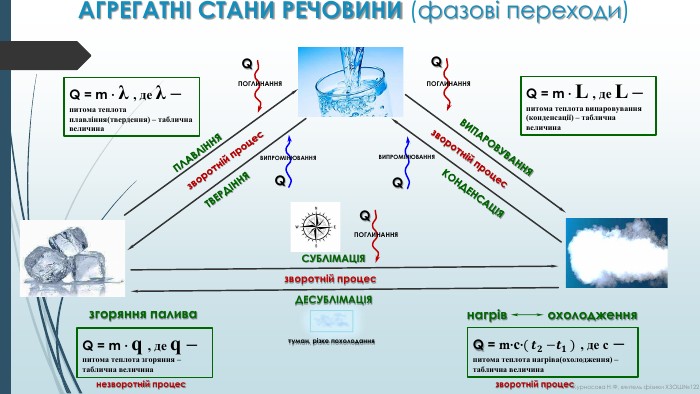
ПЛАВЛіННЯТВЕРДІННЯВИПАРОВУВАННЯКОНДЕНСАЦІЯСУБЛІМАЦІЯДЕСУБЛІМАЦІЯQQQQQПОГЛИНАННЯПОГЛИНАННЯПОГЛИНАННЯВИПРОМІНЮВАННЯВИПРОМІНЮВАННЯQ = m · λ , де λ – питома теплота плавління(твердення) – таблична величина. Q = m · L , де L – питома теплота випаровування (конденсації) – таблична величиназворотній процесзворотній процесзворотній процестуман, різке похолодання. АГРЕГАТНІ СТАНИ РЕЧОВИНИ (фазові переходи)Q = m·с·( 𝒕𝟐 −𝒕𝟏 ) , де c – питома теплота нагріва(охолодження) – таблична величина зворотній процеснагрів охолодження. Q = m · q , де q – питома теплота згоряння – таблична величиназгоряння паливанезворотній процес. Курносова Н. Ф, вчитель фізики ХЗОШ№122
ПОЛОЖЕННЯ МКТІ ПОЛОЖЕННЯІІ ПОЛОЖЕННЯІІІ ПОЛОЖЕННЯРЕЧОВИНА – ЧАСТИНКИ (МОЛЕКУЛИ, АТОМИ, ІОНИ)ЧАСТИНКИ У ПОСТІЙНОМУ РУСІЧАСТИНКИ У ПОСТІЙНОЇ ВЗАЄМОДІЇВсі речовини складаються з частинок (молекул, атомів , іонів); Молекула – найменша частинка речовини, яка зберігає її хімічні властивості. А́том (від ἄτομος — «неподільний» ) найменша частинка або буквально «тіло, яке не можна розсікти навпіл» ,хімічно неподільна частинка речовини.Іон – це атом ,у якого кількість електронів не дорівнює кількісті протонів. Позитивний іон – недостає електронів. Негативний іон - надлишок електронів. Молекули і атоми перебувають в безперервному хаотичному тепловому русі. Явище дифузії – взаємопроникнення молекул однієї речовини в іншу. Броунівський рух – безперервний невпорядкований рух дуже дрібних частинок твердої речовини, що зважені в рідиніРух молекул не зумовлений якимось причинами або процесами в речовині, він є природним станом частинок матеріїМіж молекулами і атомами завжди існують сили взаємодії – молекулярні сили. Fr, H0r, ·10−9м d3d. Сили відштовхування. Сили притягання. Сила міжмолекулярної взаємодіїr = r 0 стійка рівновагаr > r 0 притяганняr < r 0 відштовхуванняd – діаметр молекулиr – відстань між молекуламиr 0 - радіус молекули. На великих відстанях – це сили притягання, на малих відстанях – сили відштовхування. Курносова Н. Ф, вчитель фізики ХЗОШ№122
ХАРАКТЕРИСТИКИ МОЛЕКУЛМаса молекули: позначення : 𝒎𝟎 одиниця виміру : [ 𝒎𝟎 ] = 1 кг ( система СІ)Маса речовини:позначення : 𝒎 одиниця виміру : [ 𝒎 ] = 1 кг ( система СІ) 𝒎 = 𝒎𝟎⋅𝑵, де 𝑵 - кількість молекул Відносна молекулярна (атомна) маса - це маса молекули (атома), виражена в а.о.м.позначення : Мr одиниця виміру : [Мr ] = 1 а.о.м. ( система СІ) 1 а.о.м. = 1,660·10-27 кг. Позначення єлементу. Назва єлементу. Порядковий номер. Відносна молекулярна (атомна) маса𝒎𝟎 = 𝑴𝒓⋅𝟏 а.о.м. Курносова Н. Ф, вчитель фізики ХЗОШ№122
ХАРАКТЕРИСТИКИ МОЛЕКУЛМоля́рна ма́са — маса 1 моля речовини, тобто 6.02214076 × 1023 (Число Авогадро) структурних одиниць цієї речовини (атомів чи молекул чи йонов). позначення : M одиниця виміру : [ M ] = 1 КГМОЛЬ ( система СІ) Кількість речовини це кількість частинок ( структурних одиниць).позначення : ν одиниця виміру : [ν] = 1 моль ( система СІ) 1 моль – це кількість речовини, в якій міститься стільки ж частинок, як у 0,012 кг ізотопу Карбону 𝟏𝟐 С. Це число зветься Столою Авогадро і дорівнює : M = 𝒎𝟎⋅ 𝑵𝑨 , де 𝒎𝟎 - маса однієї молекули ( атома) ν = 𝑵𝑵𝑨 = 𝒎𝑴𝒓 , де 𝑵𝑨 - стала Авогадро 𝑵𝑨 = 6,02 · 𝟏𝟎𝟐𝟑 𝟏моль ВАЖЛИВО ПАМ′ЯТАТИ ! РІВНА КІЛЬКІСТЬ ЧАСТИНОК , АЛЕ РІЗНА МАСА M = 𝟏𝟎𝟑⋅ 𝑴𝒓 - зв’язок між відносною та молярною масами 1 моль6,02· 𝟏𝟎𝟐𝟑структурниходиниць Курносова Н. Ф, вчитель фізики ХЗОШ№122
ІДЕАЛЬНИЙ ГАЗІДЕА́ЛЬНИЙ ГАЗ ─ з позиції молекулярно-кінетичної теорії ─ являє собою теоретичну (математичну, фізичну) модель газувідстань між молекулами набагато більша за розміри молекулвласним об'ємом частинок газу, порівняно з наданим йому об'ємом, можна знехтуватимолекули - пружні кулісили тяжіння прагнуть до нулясили відштовхування проявляються тільки під час пружних центральних ударіврух кожної молекули - за законами Ньютоначастинки здійснюють хаотичний тепловий рух, який у всі боки абсолютно рівноправний. ВЛАСТИВОСТІ ІДЕАЛЬНОГО ГАЗУЗакон Авогадро: в рівних об’ємах за однакових умов міститься однакова кількість молекул. ЗАКОНИ ,ЯКІ ДІЮТЬ В ІДЕАЛЬНИХ ГАЗАХ1 моль ідеального газу за нормальних умов (тиск Р𝟎= 760 мм рт.ст. = 1,015· 𝟏𝟎𝟓 Па; температура Т𝟎= 273,15 К) займає один і той же об’єм 𝑽м = 22,4 · 𝟏𝟎−𝟑м𝟑моль Закон Дальтона: (для суміші ідеальних газів) тиск суміші газів дорівнює сумі парціальних тисків газів суміші: Р = Р1 + Р2 + ... + Рn . Курносова Н. Ф, вчитель фізики ХЗОШ№122
МАКРО - И МІКРО - ПАРАМЕТРИ СИСТЕМИМАКРОПАРАМЕТРИ – це величини, що характеризують стан газу в цілому. МІКРОПАРАМЕТРИ – це вел., що характеризує стан 1 молекули. P (Па) -тиск. Т ( К, °С) -температура. V (м𝟑 ) -об’эм n ( 𝟏м𝟑 ) -концентрація𝒎𝟎 ( кг ) -маса молекулиv ( мс ) -швидкість nv 𝒎𝟎 PТ V Курносова Н. Ф, вчитель фізики ХЗОШ№122
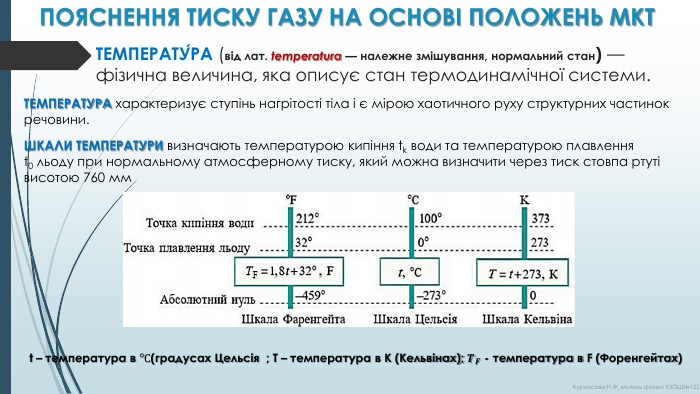
ПОЯСНЕННЯ ТИСКУ ГАЗУ НА ОСНОВІ ПОЛОЖЕНЬ МКТТЕМПЕРАТУ́РА (від лат. temperatura — належне змішування, нормальний стан) —фізична величина, яка описує стан термодинамічної системи. ТЕМПЕРАТУРА характеризує ступінь нагрітості тіла і є мірою хаотичного руху структурних частинок речовини. ШКАЛИ ТЕМПЕРАТУРИ визначають температурою кипіння tk води та температурою плавлення t0 льоду при нормальному атмосферному тиску, який можна визначити через тиск стовпа ртуті висотою 760 ммt – температура в °С(градусах Цельсія ; T – температура в К (Кельвінах); 𝑻𝑭 - температура в F (Форенгейтах) Курносова Н. Ф, вчитель фізики ХЗОШ№122
ПОЯСНЕННЯ ТИСКУ ГАЗУ НА ОСНОВІ ПОЛОЖЕНЬ МКТЗа МКТ тиск газу на стінки посудини обумовлений абсолютно пружними ударами молекул. T (температура ) ↑ ʋ (швидкість ) ↑ кількість ударів ↑ Р ↑ Тиск (Р) залежить від речовини (𝒎𝟎), кількісті молекул в даному об’ємі (n) та швидкості молекул (v ) Тиск газу повністю визначається його абсолютною температурою і концентрацією молекул: P = n k T , де n - концентрація T - температура k - стала Больцмана. РІВНЯННЯ СТАНУ СИСТЕМИ Курносова Н. Ф, вчитель фізики ХЗОШ№122
𝐄𝐊 = 𝟑𝟐 n k T k = 1,38 𝟏𝟎−𝟐𝟑 Дж. К ОСНОВНЕ РІВНЯННЯ МКТОсновне рівняння МКТ повязує між собою мікро та макропараметри системи. n. XYZv v v v v v P = 𝟏𝟑· n· 𝐦𝟎·v 𝟐, де n - концентрація, 𝐦𝟎 - маса одной молекули v 𝟐 - середня квадратична швидкість P = 𝟐𝟑· n· 𝐄𝐊 , де n - концентрація, 𝐄𝐊 - кінетична енергія молекули Стала Больцмана (k) - фізична стала, що визначає зв'язок між температурою та енергією. Курносова Н. Ф, вчитель фізики ХЗОШ№122
РІВНЯННЯ СТАНУ ІДЕАЛЬНОГО ГАЗУ. Рівняння Менделєєва - Клапейрона Рівняння стану системи об’єднує між собою три макроскопічні параметри (об’єм, тиск і температура), що описують стан даної системи: РІВНЯННЯ КЛАПЕЙРОНА: 𝑷 𝑽𝑻=𝒄𝒐𝒏𝒔𝒕 або 𝑷𝟏 𝑽𝟏𝑻𝟏=𝑷𝟐 𝑽𝟐𝑻𝟐 РІВНЯННЯ МЄНДЕЛЕЕВА - КЛАПЕЙРОНА 𝑷 𝑽𝑻=𝒎𝑴𝑹 ; 𝑷𝑽 =𝒎𝑴𝑹𝑻 ; 𝑷𝑽 =ν 𝑹𝑻 Універсальна газова стала (R) - фізична стала, що визначає зв'язок між температурою та енергією. R = 𝑵𝑨 · k = 6,02 · 𝟏𝟎𝟐𝟑 · 1,38 𝟏𝟎−𝟐𝟑 = 8,31 Джмоль ·К Курносова Н. Ф, вчитель фізики ХЗОШ№122
ГАЗОВІ ЗАКОНИ (ІЗОПРОЦЕСИ)ІЗОПРОЦЕСАМИ називаються термодинамічні процеси, що протікають у системі з незмінною масою при сталому значенні одного з параметрів стану системи.{72833802-FEF1-4 C79-8 D5 D-14 CF1 EAF98 D9}НАЗВАСПІВВІДНОШЕННЯ ПАРАМЕТРІВМАТЕМАТИЧНИЙ ЗАКОНГРАФІКИІЗОТЕРМІЧНИЙT = const𝒎 = const𝑻𝑷𝟏 ; 𝑽𝟏 𝑷𝟐 ; 𝑽𝟐Ізотермічне розширення (стиснення)Закон Бойля-Маріотта 𝑷𝟏 𝑽𝟏 = 𝑷𝟐 𝑽𝟐 P↑ 𝑉↓ або P↓ 𝑉↑ ізотермаІЗОБАРНИЙP = const 𝒎 = const𝑷 𝑻𝟏 ; 𝑽𝟏 𝑻𝟐 ; 𝑽𝟐Ізобарний нагрів(охолодження)Ізобарне розширення (стиснення)Закон Гей - Люссака 𝑽𝟏𝑻𝟏= 𝑽𝟐𝑻𝟐 Т↑ 𝑉↑ або Т↓ 𝑉↓ ізобара ІЗОХОРНИЙ V = const 𝒎 = const𝑽 𝑻𝟏 ; 𝑷𝟏 𝑻𝟐 ; 𝑷𝟐Ізохорний нагрів(охолодження)Закон Шарля𝑷𝟏 𝑻𝟏=𝑷𝟐 𝑻𝟐 Т↑ 𝑃↑ або Т↓ 𝑃↓ ізохора{72833802-FEF1-4 C79-8 D5 D-14 CF1 EAF98 D9}НАЗВАСПІВВІДНОШЕННЯ ПАРАМЕТРІВМАТЕМАТИЧНИЙ ЗАКОНГРАФІКИ ізотерма ізобара ізохора. Курносова Н. Ф, вчитель фізики ХЗОШ№122
ЗАДАЧА 30.82. На рисунку подано графік процесу, щовідбувається з ідеальним газом, у коорлинатах p(T)/Побудуйте графыки цього процесу в координатах V(T); p(V). Визначте кінцеву температуру газу. Процес 1-2:ІЗОХОРНИЙ V= const. Тиск (Р) зростаєтемпература (Т) зростає Процес 2-3:ІЗОТЕРМІЧНИЙ Т= constтиск (Р) падаєоб'єм (V) збільшується. Процес 3-4:ІЗОХОРНИЙ V= const. Тиск (Р) зростаєтемпература (Т) зростаєP2 PPV2 VV1234 PTV= const. T = const1234 V= const. Р𝟏=Р𝟑=P Т𝟒=? Т𝟐=Т𝟑=2 Т Т𝟏=Т Р𝟐=Р𝟒=P VT1234 V𝟑=V𝟒=2 V Т𝟏=Т Т𝟐=Т𝟑=2 Т Т𝟒=? V𝟏=V𝟐=2 V Процес 1-2:ІЗОХОРНИЙ V= const. Процес 2-3:ІЗОТЕРМІЧНИЙ Т= const. Процес 3-4:ІЗОХОРНИЙ V= const;V𝟑−𝟒 = V Р𝟏=P Р𝟐=2 P Т𝟏=Т Т𝟐 = 2 Т Т𝟐=Т𝟑=2 Т V𝟐=2 V V𝟑=V Р𝟐=2 P Р𝟑=P Р𝟑=P Р𝟒=𝟐 P Т𝟑=2 Т Процес 3-4:ІЗОХОРНИЙ V= const;V𝟑−𝟒 = VЗакон Шарля: Р𝟑 Т𝟑 =Р𝟒 Т𝟒 Т𝟒 =Т𝟑 ·Р𝟒 Р𝟑 Т𝟒 =𝟐 Т ·𝟐 РР = 4 Т 2. Записуємо дані з графіка Р(Т) :1. Описуємо процеси:3. Будуємо графіки V(T); p(V). 4. Виводимо із Закона та розраховуємо Т𝟒: ПЕРЕВІРЯЄМОКурносова Н. Ф, вчитель фізики ХЗОШ№122


про публікацію авторської розробки
Додати розробку

















