Урок "Будова та біологічна роль білків"
Тема. Будова та біологічна роль білків
Мета: поглибити знання учнів про будову білків та їхню біологічну роль; розвивати пізнавальну активність учнів і навички роботи у групі, виховувати повагу до іншої думки, вміння давати оцінку та самооцінку роботи
Обладнання і матеріали: підручник, презентація; яйце, м’ясо, квасоля, пір’я.
Хід уроку
І. Організаційний момент
Психологічне налаштування «Дружня долонька»
ІІ. Актуалізація опорних знань та чуттєвого досвіду учнів
«Мозковий штурм»
- Які сполуки називаються органічними?
- Які елементи належать до органогенних?
- Що є мономерами білків?
- Які зв’язки беруть участь в утворені білкових молекул?
ІІІ. Мотивація навчальної діяльності учнів
«Зацікав»
Учням демонструюються предмети : яйце, м'ясо, квасоля, пір’я.
- Що об’єднує ці предмети? (до їхнього складу входять білки)
Оголошення теми, колективне формулювання мети уроку
ІV. Вивчення нового матеріалу.
- Будова білків
Фронтальна бесіда
- Що є мономером білків?
- Які функціональні групи входять до складу амінокислот?
- Які хімічні властивості вони мають?
Учням демонструється схема утворення білкової молекули (утворення пептидного зв’язку).
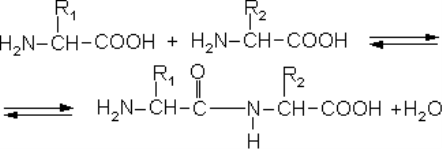
Діти характеризують хімічні властивості білків. Відповіді корегує та доповнює учитель.
- Класифікація амінокислот
«Доповни схему»
Учні доповнюють схему:

 А.К.
А.К.
Замінні Незамінні
- Рівні структурної конформації білків
«Оживи малюнок»
Дітям демонструють малюнки рівнів структурної організації білків, а вони повинні дати характеристику. Звертаючи увагу на форму молекули, зв’язки, які беруть участь в її стабілізації.
- Біологічна роль білків
Розповідь учителя з демонстрацією презентації
Каталітична функція притаманна особливим білкам - ферментам, або ензимам, що впливають на перебіг біохімічних реакцій. Каталіз (від грец. каталіз - припинення) - зміна швидкості перебігу хімічних реакцій під дією певних хімічних сполук. Каталітичну функцію в живих організмах - біокаталіз - здійснюють ферменти (мал. 10.2).
Ферменти бувають простими та складними. Прості ферменти - це білкові молекули (пепсин, трипсин тощо), які складаються лише з амінокислотних залишків. Складні ферменти, крім білкової частини, містять ще й небілкову, яку називають кофактором. Кофакторами можуть бути неорганічні катіони або аніони, а також органічні речовини (коферменти), наприклад похідні вітамінів. Білковий компонент складних ферментів визначає, яку саме реакцію каталізує певний складний фермент. Але активність складних ферментів проявляється лише тоді, коли білкова частина ферменту сполучається з небілковою.
Каталітична активність ферменту зумовлена не всією його молекулою, а лише її невеликою ділянкою - активним центром. Його просторова структура відповідає хімічній будові речовин, які вступають у реакцію. Активний центр відповідає за приєднання та перетворення сполук, що вступають у реакцію. Саме тому дія ферменту специфічна. Часто до складу активного центру входять похідні вітамінів або атоми металів. В одній молекулі ферменту може бути кілька активних центрів.
Ферменти утворюють нестійкі комплекси з речовинами, які вступають у реакцію. Ферментативна реакція перебігає в 106-1012 разів швидше, ніж у середовищі без ферментів. За кілька секунд чи навіть частки секунди в організмі відбувається складна послідовність реакцій, для проведення якої із застосуванням звичайних хімічних каталізаторів потрібні дні, тижні або навіть місяці та роки. Це пояснюють тим, що для здійснення будь-якої хімічної реакції необхідний контакт між реагентами. Аби відбулася реакція без участі ферментів, потрібна висока концентрація реагуючих речовин у середовищі або підвищена температура, за якої прискорюється рух молекул і зростає ймовірність контактів молекул реагуючих сполук. Але в організмах концентрація речовин часто дуже низька, а високі температури можуть бути небезпечними. Саме тому біохімічні реакції не можуть відбуватися без участі ферментів.
При контакті з ферментом речовина, що вступає в реакцію, орієнтується у безпосередній близькості від специфічних груп активного центру ферменту. При цьому зменшується стабільність хімічних зв’язків у її молекулі. Відомо, що для перебігу хімічної реакції молекула субстрату повинна перейти у так званий перехідний стан, коли полегшується розрив хімічних зв’язків. Енергію, необхідну для переходу субстрату в активований стан, називають енергією активації (на розрив певного зв’язку витрачається енергії не менше, ніж витрачено на його утворення). Іншими словами, енергія активації - це енергія, потрібна для того, щоб розпочалася відповідна хімічна реакція. Утворюючи комплекс “фермент-речовини, які вступають у реакцію”, ферменти знижують енергію активації. Такий комплекс швидко розпадається з утворенням продуктів реакції. Сам фермент при цьому не втрачає своєї активності і може каталізувати наступну подібну реакцію.
Одні ферменти забезпечують розщеплення певних сполук, інші - синтез. Наприклад, фермент целюлаза забезпечує розщеплення клітковини (целюлози). Якщо в реакції беруть участь дві сполуки або більше, кожна з них взаємодіє з ферментом. Фермент при цьому утримує їх близько одна від одної, забезпечуючи реакцію.
Активність ферменту проявляється лише за певних умов: тих чи інших значень температури, тиску, рН тощо. Існують і спеціальні речовини, здатні регулювати активність ферментів. Вони зв’язуються з активними центрами ферментів і блокують їхню активність. У ролі таких речовин - інгібіторів можуть виступати йони важких металів: Плюмбуму (Pb), Арсену (As), Аргентуму (Ag).
Ферментативні реакції відбуваються у вигляді низки послідовних етапів (до декількох десятків). Ланцюги взаємопов’язаних ферментативних реакцій загалом забезпечують обмін речовин і перетворення енергії в окремих клітинах й організмі в цілому.
Ферменти мають певне розташування як у межах окремої клітини, так і в організмі в цілому. У клітині багато ферментів пов’язані з плазматичною мембраною або мембранами окремих органел (мітохондрій, пластид тощо).
Демонстрація «Дія ферменту» на прикладі сирої та вареної картоплі
- Функції білків
Робота з підручником, складання ОК у формі таблиці.
Учні опрацьовують матеріал підручника, заповнюють таблицю
|
Функція |
Коротка характеристика |
Приклад |
|
|
|
|
|
|
|
|
|
|
|
|
V. Узагальнення, контроль і систематизація знань
1. «Термінологічний ланцюжок»
Учні по черзі називають терміни, які вивчили на уроці, адресуючи однокласнику, який і дає визначення даного поняття.
2. «ТАК чи НІ?»
1) зв’язок, який виникає між амінногрупою однієї а.к. та карбоксильною групою іншої називається пептидним
2) третинна структура білка представлена спіраллю
3) білки складаються з нуклеотидів
4) каталітична активність ферменту зумовлена всією його молекулою
5) активність ферменту залежить від певних умов
VІ. Підсумки
Оцінювання роботи учнів на уроці
Оцінка уроку учнями (з використанням смайликів)



VІІ. Домашнє завдання
Домашнє завдання диференційоване по рівням навченості та пізнавальної активності учнів:
вивчити параграф підручника, біологічний словник; підготувати розповідь «Важливий фермент»; дослідити властивості білків


про публікацію авторської розробки
Додати розробку
