Електричний струм в рідинах

З М І С Т :
2.1. Природа електричного струму в рідинах
Вивчаючи хімію ви не раз чули про те, що молекули рідин є нейтральними, тобто незарядженими. А це означає, що носіїв заряду в чистій рідині немає. Тобто рідини за своєю природою не є провідниками струму. Однак на уроках ОБЖ, в фільмах та й у власному житті ви стикались з тим, що, наприклад, вода є провідником струму. Чому ж практика суперечить теорії?
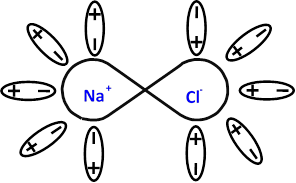 Розглянемо, наприклад, дистильовану воду – чистку хімічну сполуку Н2О, її молекули дійсно заряджені нейтрально, але центри додатних та від’ємних зарядів в них не збігаються, про такі молекули кажуть, що вони є полярними або диполями. Молекули води, як ви пам’ятаєте з
Розглянемо, наприклад, дистильовану воду – чистку хімічну сполуку Н2О, її молекули дійсно заряджені нейтрально, але центри додатних та від’ємних зарядів в них не збігаються, про такі молекули кажуть, що вони є полярними або диполями. Молекули води, як ви пам’ятаєте з
молекулярної фізики, рухаються безладно, хаотично. При внесенні води в зовнішнє електричне поле, її нейтральні частинки продовжуватимуть хаотичний рух, тобто дистильована вода не є провідником електричного струму.
Додамо до води кухонну сіль NaCl, молекули якої також є полярними. Диполі води "обліплюють" молекулу солі орієнтуючись додатними полюсами до її від’ємної частини, і від’ємними до додатної. При цьому молекули води розтягують сольовий диполь притягаючи одну його частину, наприклад додатно заряджену, і відштовхуючи іншу – негативно заряджену. Таким чином послаблюються зв’язок між додатнім іоном Na та від’ємним іоном Cl, настільки, що енергії теплового руху вистачає на те, щоб цілком зруйнувати цей зв’язок, і відокремити іони один від одного.
Такий процес утворення іонів при розчиненні називають дисоціацією. При зустрічі позитивного іона з негативним може відбутись їхнє сполучення в молекулу, тобто має місце зворотній процес, який називають рекомбінацією. У розчинах, якщо не існує зовнішнього електричного поля, процеси дисоціації та рекомбінації при сталій температурі перебувають у динамічній рівновазі.
Здатність дисоціювати у різних рідин різна і для кількісної характеристики ступеня дисоціації вводять коефіцієнт або ступінь дисоціації, який показує яка частина молекул розчиненої речовини розпалась на іони.
n
![]() ,
,
N
де n – кількість дисоційованих молекул,
N – загальна кількість молекул.
Коефіцієнт дисоціації залежить від концентрації розчину. Для = 1 дисоціація буде повна, а при = 0 – відсутня.
Іони є зарядженими частинками, тому можуть бути носіями заряду. Речовини в яких носіями заряду є саме іони називають електролітами. Якщо 1, то такий електроліт називають сильним, а при 0 слабким.
До них належать розчинені солі (KCl, AgCl, NaCl, AgBr) і тверді тіла; кристали галоїдних, азотнокислих і сірчанокислих сполук лужних та лужноземельних металів (NaCl, KCl, AgNO3, BaCl2, BaJ2). Найбільш типовими представниками електролітів є водні розчини неорганічних кислот (HCl, H2SO4, HNO3), лугів (NaOH, KOH, Ca(OH)2), солей (NaCl, AgNO3, CuSO4).
Однак, не всі водні розчини є електролітами. Так розчин цукру у воді не є електролітом.
Дисоціація також може відбуватись якщо через рідину пропускати електричний струм.
Розклад електролітів на складові при проходженні крізь них електричного струму називається електролізом.
Якщо в деякий електроліт занурити провідники підключені до джерела напруги – електроди, то спостерігатиметься впорядкований рух іонів в електричному полі створеному електродами. Додатні іони, що рухатимуться до від’ємного електрода – катода, називають катіонами, а від’ємні, які рухатимуться до анода – аніонами.
Досягаючи катоду та взаємодіючи з ним катіони отримують електрони, яких їм не вистачало і виділяються у вигляді нейтральних атомів або молекул, а на зміну електронам, що пішли на нейтралізацію іонів від батареї до катоду надходить нова кількість електронів. Так само від’ємні іони при взаємодії з анодом віддають зайві електрони, перетворюючись на нейтральні частинки, а електрони по металевим провідникам ідуть в батарею.
2.2. Закони Фарадея
Таким чином струм в електроліті обумовлений іонами, що рухаються, а на електродах відбувається їх нейтралізація та виділення у вигляді нейтральних атомів або молекул. Кожен іон, що осідає на електроді переносить з собою деякий електричний заряд. Це означає, що повний заряд, перенесений всіма іонами має бути пропорційним до кількості іонів, що осіли на електродах, тобто масі речовини, що виділилась.
Саме такий висновок після численних дослідів сформулював Фарадей в 1833р. Ця залежність отримала назву першого закону електролізу або першого закону Фарадея. ![]() Маса речовини, що виділилась на електроді при проходженні крізь електроліт струму, прямо пропорційна заряду (або кількості електрики), що пройшов крізь електроліт.
Маса речовини, що виділилась на електроді при проходженні крізь електроліт струму, прямо пропорційна заряду (або кількості електрики), що пройшов крізь електроліт.
m K q K I t
K – електрохімічний еквівалент – величина, що показує яка маса речовини виділяється при електролізі одним кулоном електрики, що пройшла крізь електроліт.
Електрохімічні еквіваленти деяких речовин
|
Речовина |
K 106 кг/Кл |
|
Срібло (Ag+) Водень (H+) Мідь (Cu2+) Цинк (Zn2+) |
1,12 0,0104 0,329 0,339 |
З таблиці видно, що електрохімічні еквіваленти різних речовин є різними. Від яких саме властивостей речовини залежить величина електрохімічного еквівалента? Відповідь на це питання дає наступний закон, також встановлений Фарадеєм дослідним шляхом: ![]() Електрохімічний еквівалент речовини прямо пропорційний молярній масі речовини і обернено пропорційний валентності цієї речовини.
Електрохімічний еквівалент речовини прямо пропорційний молярній масі речовини і обернено пропорційний валентності цієї речовини.
1
![]() K
K
F n
![]() – хімічний еквівалент – величина, що показує, яка маса речовини, що виділилась
– хімічний еквівалент – величина, що показує, яка маса речовини, що виділилась
n потрібна для заміщення одного моля водню в хімічному сполученні.
F – стала Фарадея
![]() F e N a 9,648 10 4
F e N a 9,648 10 4 ![]() Кл моль
Кл моль
Враховуючи другий закон електролізу перший можна переписати у вигляді:
![]() m 1 q 1 I t, або
m 1 q 1 I t, або
F n F n
![]() m 1 q 1 I t e N a n e N a n
m 1 q 1 I t e N a n e N a n
Ця формула виражає третій – об’єднаний закон електролізу:
![]() Маса речовини, що виділилась на електроді при проходженні крізь електроліт струму, прямо пропорційна заряду (або кількості електрики), що пройшов крізь електроліт та хімічному еквіваленту цієї речовини.
Маса речовини, що виділилась на електроді при проходженні крізь електроліт струму, прямо пропорційна заряду (або кількості електрики), що пройшов крізь електроліт та хімічному еквіваленту цієї речовини.
До законів електролізу можна прийти шляхом таких міркувань:
маса речовини, що виділяється на електродах це сума мас всіх молекул, що осіли на електроді або добуток маси однієї молекули на їх кількість m m N 0 ;
Заряд, що пройшов по колу під час осідання речовини масою m q q N 0 ,
де q0 – заряд одного іону, тоді кількість іонів, що нейтралізувались на електроді:
q q
N ![]() , q0 ne
, q0 ne
враховуючи, що q n e0 , де n – валентність іону.
q
m m0 ![]()
ne
m N0 a m0 ![]()
Na
![]() m q 1 q Na ne eNa n
m q 1 q Na ne eNa n
![]() m 1 q 1 I t
m 1 q 1 I t
F n F n m K q
2.3. Застосування електролізу
Явище електролізу дістало широкого застосування в багатьох галузях виробництва:
1. Електрохімічна обробка ("змивання" зайвого шару металу з обробленої деталі, полірування деталей, що мають втримувати значні навантаження, отримання глибоких та точних отворів, виготовлення деталей аеродинамічного профілю загострювання медичних інструментів, обробка металевих археологічних знахідок і т.д.);
2. Очистка (рафінування) речовин: металів(Електрометалургія — виділення чистих металів із природних сумішей та промислових відходів(міді із мідного колчедану, алюмінію із розплавленого бокситу, срібла із відходів фотовиробництва)), води, отримання чистих газів, шкіри (дарсонвалізація)
3. Гальванопластика (відкладення товстого шару металу, який відшаровується і використовується самостійно (отримання матриць для друкарських пластинок, створення матриць для штампування грампластинок, картин, ювелірних прикрас, зубних протезів, барельєф і т. п.)).
4. Гальваностегія — покриття деталей тонким шаром металу, що володіє заданими властивостями з метою запобігання корозії, механічним ушкодженням та для надання привабливого вигляду. (позолота, нікелювання, хромування тощо);


про публікацію авторської розробки
Додати розробку
