План-конспект кроку на тему "Будова речовини. Атоми і молекули"
Урок № 12
Тема: Будова речовини. Атоми і молекули. Рух і взаємодія атомів і молекул.
Мета: базуючись на знаннях, отриманих учнями на уроках природознавства, поглибити уявлення учнів про будову речовини, атоми, молекули, з’ясувати причини різних властивостей речовин, розглянути рух і взаємодію молекул;
Тип: урок засвоєння нових знань.
План уроку:
1. Організаційна частина.
2. Актуалізація опорних знань.
3. Вивчення нового матеріалу.
4. Закріплення вивченого матеріалу.
5. Домашнє завдання.
Хід уроку.
І. Організаційний момент.
Оголошення теми і мети уроку.
ІІ. Актуалізація опорних знань.
- Дати означення: тіло, речовина, матерія.
- Розповісти про властивості твердих тіл, рідин і газів.
- Яку речовину людина найбільше використовує?
- Чому властивості тієї ж речовини в різних агрегатних станах різні?
ІІІ. Вивчення нового матеріалу.
З попереднього курсу «Природознавство» ви вже знаєте, що всі речовини складаються з дрібних частинок — молекул та атомів. Ви також знаєте, що первинні складові речовини — атоми — мають спеціальні назви та символи для позначення кожного з видів атомів. Наприклад: Гідроген (Н), Меркурій (Нg), Оксиген (О), Карбон (С). Атоми різних видів відрізняються один від одного своїми хімічними властивостями та масою. З фізичною величиною під назвою «маса» ви вже познайомилися в нашому курсі. Що таке «хімічні властивості», ви дізнаєтеся з курсу хімії.
Станом на 2005 рік науці відомі тільки 116 різних видів атомів. «Не може бути,— заперечите ви.— Як це, тільки 116? Кожний із нас із легкістю перелічить 200—300, а може, і більше різних речовин». Так, дійсно, у світі існують мільйони різних речовин. Як же поєднати існування тільки 116 видів атомів з мільйонами різних речовин? Річ у тім, що речовини здебільшого складаються з молекул.
Молекулою називається найменша частинка речовини, що має її основні хімічні властивості та складається з атомів.
Ситуація з різними речовинами дуже подібна до складання тисяч різних слів із «тільки» 33-х літер абетки. У цьому порівнянні кожна літера — це, так би мовити, окремий атом, а кожне слово відповідає певній молекулі, тобто певній речовині.
Анкета для атома.
Ім’я: Атом – найдрібніша частинка речовини.
Демокріт, Левкіпп – 2500 р. тому, давньогрецькі вчені, гіпотеза про існування атомів.
18 – 19 ст. – здогадка підтвердилась.
Існують: різні види – понад сто. Це хімічні елементи. Менделєєв.
Земна кора – 8хімічних елементів, 99%.
Спосіб існування: окремо або в молекулах.
![]() З однакових атомів – проста речовина (оксисен,
З однакових атомів – проста речовина (оксисен,
![]() Молекула гідроген).
Молекула гідроген).
З різних атомів – складна речовина:
вода сіль цукор
Призначення в природі: визначити відмінні від інших певні властивості речовини.
Місце існування: будь-яке тіло.
Знайомимося з простими та складними речовинами
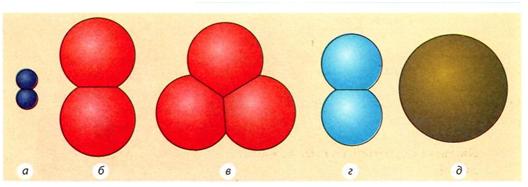
Продовжимо нашу аналогію речовин зі словами. Ви знаєте, що поряд зі словами, які складаються з декількох різних літер, ми іноді вимовляємо і слова з використанням тільки однієї літери (наприклад, «я», «аа...», «ууу...»). Так само і з речовинами. Декілька з них складаються тільки з одного виду атомів (одного хімічного елемента) і тому називаються простими ( рис. 1). Прикладами таких речовин є вуглець, залізо та ін.
Рис. 1 Моделі молекул простих речовин: а — водню (Н2); б— кисню (02); в — озону (03); г — азоту (N2); д — заліза (Fе)
Цілком очевидно, що слів, які складаються з декількох літер, набагато більше, ніж слів з однієї літери. Так само і з речовинами. Найчастіше в повсякденному житті ми маємо справу з речовинами, які складаються з атомів декількох різних сортів. Ці речовини так і називаються — складні.
Нагадаємо, що в науковій літературі, щоб уникнути плутанини, застосовують різні назви для простих речовин і для хімічних елементів, із яких ці речовини складаються.
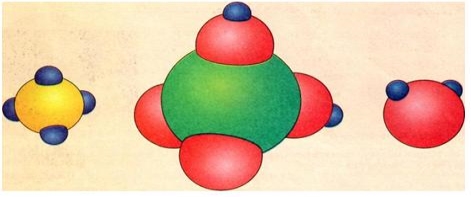
Рис. 2 Моделі молекул деяких речовин: а — метану; б — сірчаної кислоти (Н4S04); в — води (Н20).
Переконуємося в наявності проміжків між молекулами
Після того як ми познайомилися з найменшими частинками речовини, пригадаймо деякі відомості про будову речовини. У результаті досліджень учені з'ясували, що між молекулами (атомами) існують проміжки. Цей висновок учених можна легко підтвердити досить простим дослідом. Якщо змішати 100 мл води і 100 мл спирту, то об'єм суміші буде меншим, ніж 200 мл. Після змішування двох рідин молекули води потрапляють у проміжки між молекулами спирту. Наведений дослід можна змоделювати, наприклад, за допомогою пшона і гороху (рис. 3). Наповніть склянку до половини пшоном, а потім додайте стільки ж гороху. Ви одержите двошарову композицію та до краю заповнену склянку. Акуратно перемішайте цю композицію, і ви побачите, що об'єм суміші буде меншим, ніж вихідний,— частина пшона розмістилась у порожнинах між горохом.
Рис. 3.Моделювання явища зменшення об'єму в результаті змішування різних рідин. Якщо взяти горох і пшоно (a) і ретельно перемішати їх, побачимо, що об'єм суміші менший за суму об'ємів її компонентів (б). Це можна пояснити тим, що крупинки пшона потрапили в проміжки між горошинами
Намагаємось уявити собі розміри атомів
Атоми є дуже малими. З'ясовано, що розміри атомів приблизно дорівнюють 10-10м (0,0000000001 м). Щоб уявити, наскільки малим є це значення, наведемо таке порівняння: діаметр молекули в стільки ж разів менший за діаметр яблука, у скільки разів діаметр яблука менший, ніж діаметр Землі.
Про розміри атомів також можна судити з прикладу. Якби всі люди нашої планети проводили все життя, займаючись тільки лічбою, усі разом ми змогли б полічити атоми тільки в головці однієї малої шпильки.
Пригадуємо будову атома
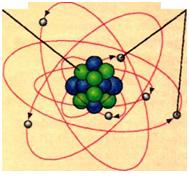
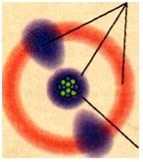
Досліди показали, що атом має складну структуру. Він являє собою позитивно заряджене ядро, оточене хмарою легких частинок — електронів, які мають негатив ний заряд (рис. 4). Маса ядра незначно відрізняється від маси атома. Маса ж електронів порівняно з ядром дуже мала.
Ядро(+) Електрони (-) Електрони (-)
Ядро (+)
Рис. 2.14. Моделі атома: а — планетарна модель: у центрі атома — ядро, навколо ядра обертаються електрони; б — сучасна: електрони нібито «розмазані» по орбіталях — частинах простору, що оточують ядро. Для наочності на рисунку відстань від ядра до електронів показано у 2—3 рази більшою, ніж діаметр ядра. Насправді ця відстань перевищує розмір ядра в 100 000 разів
IV. Закріплення вивченого матеріалу.
1. Скільки різних видів атомів відомі науці? Чим вони відрізняються один від одного?
2. Які речовини називають простими? Наведіть приклади.
3. Наведіть приклади деяких складних речовин. Із яких атомів вони складаються?
4. Як можна довести, що між частинками речовини існують проміжки?
5. Як довести, що атоми й молекули є дуже малими?
6. У перекладі з грецької «атом» означає «неподільний». Чи так це?
Вправи
1. Чи можемо ми стверджувати, що об'єм речовини в посудині дорівнює сумі об'ємів молекул, із яких ця речовина складається?
2. Чи можемо ми змінити об'єм тіла, не змінюючи кількості молекул у ньому? Як це зробити?
3. Відомо, що за однакових умов різні гази в однаковому об'ємі містять ту саму кількість молекул, а густини газів є різними. Чим можна пояснити розходження в густині газів?
4. Обчисліть, скільки приблизно молекул можна розмістити вздовж відрізка завдовжки 0,5 мм. Діаметр молекули вважати таким, що дорівнює 0,0000000001 м.
5. Відомо, що наша Галактика Молочний (або Чумацький) Шлях налічує близько 9 млрд зір. У скільки разів кількість молекул в 1 см3 повітря, яка дорівнює (за нормальних умов) 3 • 1010, є більшою від зазначеної кількості зір?
6. Площа плівки, яку утворює на поверхні води крапля олії об'ємом 0,005 мм3, не може перевищувати 50 см2. Який висновок щодо розміру молекул олії випливає з цього факту?
V. Домашнє завдання:
§ 11, 12, 13
1


про публікацію авторської розробки
Додати розробку