Урок "Органічні речовини їх різноманітність за значенням в існуванні живих істот."
Тема: Органічні речовини їх різноманітність за значенням в існуванні живих істот.
І. Актуальність теми:
Органічні речовини – це сполуки Карбону з іншими елементами, що виникли в живих істотах або є продуктами їхньої життєдіяльності. Органічні сполуки присутні в атмосфері, поверхневих і підземних водах, осадах, ґрунтах і гірських породах. У складі органічних сполук переважають органогенні хімічні елементи (Гідроген, Оксиген, Нітроген і Карбон). Ковалентно-зв’язані атоми Карбону утворюють ланцюжки або ряди кілець (так званий скелет молекули). До складу клітин входять різні органічні сполуки: ліпіди, вуглеводи, білки, нуклеїнові кислоти тощо
План
1. Що входить до органічних речовин
2. Визначення ліпіди
3. Функції ліпідів
4. Визначення амінокислоти
5. Будову та функції
Органічні речовини — це сполуки Карбону з іншими хімічними елементами. Назву «органічні» вони дістали тому, що спочатку вважалося: живі організми й тіла неживої природи побудовані з абсолютно різних сполук, тобто речовини, властиві живим організмам, можна отримати лише від живого, «від організму». І тільки коли з амоніаку NН3 та вуглекислого газу СО2 було синтезовано органічну сполуку - сечовину (CH4N2O), стало очевидним, що речовини, які входять до складу живих організмів, за своїм складом не відрізняються від хімічних сполук тіл неживої природи. Нині описано структуру понад 10 млн. органічних сполук, частину з них виділено з живих організмів, однак значно більшу кількість синтезовано в лабораторіях.
Органічні сполуки можуть бути гідрофільними — розчинними у воді та гідрофобними — не розчинними. Обов’язковими компонентами будь-якої клітини є органічні сполуки чотирьох класів: білки, нуклеїнові кислоти, вуглеводи і ліпіди. Серед відходів виробництва існує багато органічних сполук, що є чужорідними для живих істот, тому вони не засвоюються організмами, а накопичуються в навколишньому середовищі. Деякі з них, потрапляючи в організм людини, завдають шкоди не тільки її здоров’ю, але й майбутнім поколінням.
Особливості будови органічних сполук:
Основним типом хімічного зв’язку в молекулах органічних речовин є ковалентний зв’язок. Це найміцніший тип хімічного зв’язку. Він виникає внаслідок утворення спільних електронних пар атомів, що приводить до зв’язування різних атомів в одну молекулу. При цьому пара електронів одночасно належить сусіднім атомам. Особливо міцні зв’язки утворюються між атомами Оксигену, Карбону, Гідрогену і Нітрогену, які становлять, 98 % маси клітини. Річ у тім, що чим легші елементи, тим міцніші між ними ковалентні зв’язки, а згадані О, С, Н і N є найлегшими з хімічних елементів, здатних утворювати такий тип зв’язків. Найпростішою органічною сполукою є метан.
Ланцюги зі зв’язаних ковалентними зв’язками атомів Карбону утворюють основу, «скелет» молекули. Крім невід’ємних для всіх органічних сполук елементів Карбону і Гідрогену, в них майже завжди наявний Оксиген, рідше — Нітроген. Крім того, до складу органічних сполук можуть входити Фосфор і значно рідше — Сульфур, а до деяких складних органічних сполук — ще і йони металів (Fe2+, Cu2+, Mg2+). Іноді до складу органічних сполук входять залишки молекул неорганічних сполук, частіше за все — похідних ортофосфатної кислоти. Силіцій має ті самі хімічні властивості, що й Карбон, і утворює в лабораторних умовах величезну кількість речовин, зокрема всім відомий силікон. Проте внаслідок того, що атом Силіцію у 2,5 рази важчий за атом Карбону, а його ковалентні зв’язки з іншими атомами слабкіші, він не може бути повноцінним конкурентом Карбону і формувати такі довгі, міцні й хімічно активні молекули, як Карбон.
Хімічна структура і властивості органічних сполук.
Незважаючи на те, що понад 98 % складу органічних сполук складаються лише з чотирьох елементів, їх загальна кількість у сотні разів більша за число неорганічних речовин, які утворюються значною кількістю хімічних елементів. Найпростіші органічні сполуки складаються з атомів Карбону й Гідрогену і мають назву вуглеводні. Саме вони входять до складу природного газу і нафти. Оскільки молекули вуглеводнів неполярні, вони не розчиняються у воді і мають гідрофобні (від грец. гідро — вода і фобос — страх) властивості. Вуглеводні, молекули яких містять не більше 4 атомів Карбону, є газами, від 5 до 10 атомів Карбону — рідинами, а понад 10 — твердими речовинами. Вуглеводні, у карбонових ланцюгах яких між атомами Карбону існують одинарні зв’язки, називаються насиченими, а вуглеводні, що мають подвійні зв’язки між атомами Карбону в молекулах, — ненасиченими. Карбоновий ланцюг може мати лінійну форму або циклічну — утворювати кільце. Причому кільце з шести атомів Карбону, в яких є три подвійних зв’язки, називається бензольним кільцем. Воно є основою багатьох органічних речовин, які називаються ароматичні сполуки. Вони відіграють важливу роль в живих системах, зокрема їх похідні є компонентами деяких амінокислот. Найпростіші органічні сполуки, до складу яких входить Оксиген, називаються спиртами. Молекули спиртів полярні, їм притаманні властивості слабких кислот, вони розчиняються у воді й належать до гідрофільних сполук. Спирти, які мають одну гідроксильну группу (–ОН), називаються одноатомними, якщо дві й більше - багатоатомними. Особливого значення в живих організмах набувають сполуки триатомного спирту — гліцерину. Цікаво, що триатомний спирт (гліцерин) для організму людини — речовина не лише нешкідлива, а й необхідна, тоді як двохатомний спирт (етиленгліколь) — отрута. Якщо в молекулі органічної сполуки між атомом Оксигену й атомом Карбону є подвійний зв’язок, то ця речовина належить до альдегідів, кетонів, карбонових кислот або їх похідних. Наприклад, глюкоза і фруктоза, необхідні клітині, містять у складі молекул залишки альдегідів або кетонів відповідно. Полярні властивості притаманні молекулам карбонових кислот. У цих сполуках міститься карбоксильна група (–СООН). Карбонові кислоти відіграють важливу роль у метаболізмі, оскільки є проміжною ланкою багатьох хімічних реакцій, карбонові кислоти з кількістю атомів Карбону в молекулі 15 і більше входять до складу жирів. Спирти і карбонові кислоти здатні реагувати між собою з утворенням особливих груп органічних сполук — етерів та естерів, наприклад, діетиловий етер має формулу С2Н5–О–С2Н5.
Органічні сполуки, молекули яких складаються з двох частин (залишків великих молекул), одна з яких гідрофобна, а друга гідрофільна, мають амфіфільні (від грец. амфі — з двох боків і філео — люблю) властивості. Саме до цієї групи органічних сполук належать органічні речовини, які становлять основу клітинної мембрани.
Що таке біомолекули:
Біомолекули — це молекули органічних речовин, які мають біологічну активність. Як правило, біомолекули утворюються в живих організмах, проте сучасний розвиток науки відзначається активним синтезом цих речовин в лабораторних умовах. Навіть найпростіші спирти, альдегіди, кетони, карбонові кислоти й амінокислоти (структурна ланка білків) утворюються в об’єктах живої природи. Саме з цих невеликих молекул в клітинах синтезуються величезні за розміром молекули, які називають високомолекулярними сполуками, їх маса нараховує тисячі й мільйони атомних одиниць.
Найбільш прості органічні сполуки — вуглеводні, які містяться в земній корі, ніколи не бувають компонентами живого. Чому біомолекули такі різноманітні. Всього виокремлюють чотири основні групи органічних сполук, що неодмінно входять до складу клітини будь якого організму: білки, нуклеїнові кислоти, вуглеводи і ліпіди. Крім того, до складу клітини входить ще багато органічних сполук, які мають певну біологічну активність. Органічні речовини становлять близько 15 % від маси клітини.
Органічні речовини, що входять до складу живих організмів, дуже різноманітні за своєю будовою. Причина такого різноманіття на перший погляд проста: різна будова — різні функції. Зрозуміло, що за своєю будовою дуже відрізняються різні класи біологічно активних речовин. Крім того, в межах цих класів існують певні групи, види і різновиди білків, ліпідів, вуглеводів та інших речовин, які також спеціалізовані на виконанні певних функцій, що приводить до збільшення різноманіття біологічних молекул. При цьому правильним буде припущення, що чим більш розвинений організм, тим більше в ньому працює різноманітних речовин.
Однак існує ще один рівень різноманіття — різноманіття біомолекул, які виконують у різних організмах однакові функції, але, незважаючи на це, мають відмінності в структурі. Це стосується найбільших за розмірами молекул: білків та нуклеїнових кислот ДНК. При цьому це різноманіття настільки велике, що не піддається підрахунку. Вважається, що кожний організм, який виник внаслідок статевого розмноження, має свої і тільки свої унікальні молекули ДНК. Це означає, що скільки на планеті багатоклітинних істот, стільки ж молекул ДНК зі своєю особливою структурою. Крім того, кожний вид характеризується особливим складом білків. Це, у свою чергу, доводить, що на планеті існують мільйони різних білків. При цьому слід зазначити, що будова інших органічних молекул (жирів, вуглеводів, вітамінів тощо) досить стала, а в деяких випадках і універсальна для всіх груп рослин і тварин.
Кожна особи на унікальна за своїми ознаками і будовою, що є наслідком неповторності будови генетичного апарату, який, перш за все, складається з ДНК. Тому питання про причини різноманіття макромолекул — це не питання біохімії, а загально біологічна проблема індивідуальної мінливості. Дійсно, кожна особина, зокрема серед людей (за винятком двояйцевих близнюків), є за своїми ознаками і будовою унікальною особистістю, в тому числі і на біохімічному рівні. Кожен з нас має свій неповторний набір біохімічних речовин, кожен — єдиний у світі унікум. Органічні речовини в середовищі існування. Навколишнє середовище містить величезну кількість органічних речовин природного походження: це, наприклад, рештки померлих тварин і рослин, що утворюють гумус або водяну органіку. Крім того, у воді, повітрі та ґрунті за останні п’ятдесят років накопичилося багато синтетичних органічних сполук. Ці речовини, хоча й винайдені людиною начебто для її ж користі, є чужорідними не тільки для людського організму, але й живої природи в цілому. Викликає занепокоєння, що з року в рік концентрація ксенобіотиків у довкіллі стає все більшою, а це, поряд зі зростаючим дефіцитом природних ресурсів, вже ставить під сумнів не тільки можливість існування сучасної цивілізації, але й взагалі живої природи в її теперішньому вигляді. Загрозливого масштабу, наприклад, набуло накопичення фреону у верхніх шарах атмосфери. Фреони — це негорючі гази, які складаються з флуорпохідних метану та етану. Їх використовують в холодильних установках, кондиціонерах. Оскільки молекули цих речовин дуже інертні й легші за повітря, вони накопичуються у верхніх шарах атмосфери, що призводить, на думку багатьох вчених до потоншення шару озону. Адже саме озон стримує потоки ультрафіолетового випромінювання, захищаючи живі організми від великих доз, які є шкідливими. Там, де шар цього газу стає дуже тонким, утворюються так звані «озонові діри». У таких місцях населення отримує з космосу додаткові дози опромінення, що призводить, як вважається, до різкого зростання випадків захворювання на рак шкіри. Не безпеку для живого несуть й інші речовини, синтезовані людиною, все більша кількість яких акумулюється в навколишньому середовищі. Це стосується поліетилену та різного роду пластмас, що зберігаються в ґрунті чи воді тисячоліттями, не включаючись у природні цикли. Особливе занепокоєння викликають нафтопродукти, які щорічно тисячами тонн виливаються з танкерів у Світовий океан і на десятки років роблять акваторії сотні квадратних кілометрів непридатними для життя. Загрозу життю і здоров’ю не тільки нинішнього, але й майбутніх поколінь людей становлять різні отрутохімікати — пестициди (від лат. пестіс — зараза і цидо — вбиваю), синтезовані для знищення різноманітних комах шкідників сільського господарства, патогенних грибків та бур’янів. Пестициди, як з’ясувалося, здатні вбивати не тільки комах, але й поволі отруювати організм самих винахідників. Тільки цей процес у людей, на відміну від комах, які вмирають миттєво, розтягується на десятки років, тому не такий помітний. Найбільш небезпечним наслідком використання отрутохімікатів є той факт, що ці речовини не лише негативно впливають на організми сучасників, але здатні згубно діяти на їх нащадків.
Білки
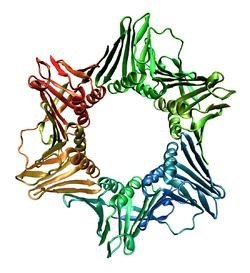
Білки — складні високомолекулярні природні органічні речовини, що складаються з амінокислот, сполучених пептидними зв'язками. В однині (білок) термін найчастіше використовується для посилання на білок, як речовину, коли не важливий її конкретний склад, та на окремі молекули або типи білків, у множині (білки) — для посилання на деяку кількість білків, коли точний склад важливий.
Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом. Хоча генетичний код більшості організмів визначає лише 20 «стандартних» амінокислот, їхнє комбінування уможливлює створення великого різномаїття білків із різними властивостями. Крім того, амінокислоти у складі білка часто піддаються посттрансляційним модифікаціям, які можуть виникати і до того, як білок починає виконувати свою функцію, і під час його «роботи» в клітині. Для досягнення певної функції білки можуть діяти спільно, і часто зв'язуються, формуючи великі стабілізовані комплекси (наприклад, фотосинтетичний комплекс).
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни. Проте, їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком. Секвенування першого білка — інсуліну, тобто визначення його амінокислотної послідовності, принесло Фредерику Сенгеру Нобелівську премію з хімії 1958 року. Перші тривимірні структури білків гемоглобіну і міоглобіну були отримані за допомогою рентгеноструктурного аналізу, за що автори методу, Макс Перуц і Джон Кендрю, отримали Нобелівську премію з хімії 1962 року.
Історія дослідження
Білки були виділені в окремий клас біологічних молекул в 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати при нагріванні або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці. Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
Мульдеру також належить перша модель хімічної будови білків, запропонована ним у 1836 році. Виходячи з теорії радикалів, він сформулював поняття про мінімальну структурну одиницю в складі білків. Саме ця одиниця зі складом C16H24N405 отримала пізніше назву «протеїну» (Pr), а концепція — теорії протеїну[4]. Сам термін «протеїн», що в сучасному розумінні означає білок більшістю європейських мов, був запропонований у 1838 році співробітником Мульдера Якобом Берцеліусом. Перевірка цієї моделі привернула увагу відомих хіміків свого часу, таких як Юстус Лібіх і ЖанБатист Дюма. Під впливом нових даних теорія протеїну декілька разів корегувалася, але все ж до кінця 1850-х років від неї довелося повністю відмовитися.
До кінця 19-го століття вже було досліджено більшість амінокислот, що входять до складу білків. В 1894 році німецький фізіолог Альбрехт Коссель висунув теорію, що амінокислоти є головними структурними елементами білків. На початку 20-го століття німецький хімік Еміль Фішер експериментально доказав, що білки збудовані з залишків амінокислот, сполучених пептидними зв'язками. Також він виконав перші аналізи амінокислотного складу білків та дав пояснення протеолізу. Після 1926 року також стала зрозумілою центральна роль білків в організмах, коли американський хімік Джеймс Самнер (згодом — лауреат Нобелевської премії) показав, що фермент уреаза також є білком.
Вивченню білків перешкоджала складність їхнього виділення. Тому перші дослідження білків проводилися з використанням тих поліпептидів, які могли бути очищені у великій кількості, тобто білків крові, курячих яєць, різних токсинів і травних/метаболічних ферментів, які можна було виділити в місцях забою худоби. В кінці 1950-х років компанія Armour Hot Dog Co. змогла очистити кілограм бичачої панкреатичної рибонуклеази А, яка стала експериментальним об'єктом для багатьох учених.
Ідея про те, що вторинна структура білків утворюється в результаті формування водневих зв'язків між амінокислотами, була висловлена Вільямом Астбері в 1933 році, але Лайнус Полінг вважається першим ученим, який зміг успішно передбачити вторинну структуру білків. Пізніше Волтер Каузман, спираючись на роботи Кая Ліндерстрем-Ланга, вніс вагомий внесок до розуміння законів утворення третинної структури білків і ролі в цьому процесі гідрофобних взаємодій. У 1949 році Фред Сенгер визначив амінокислотну послідовність інсуліну, продемонструвавши таким способом, що білки — це лінійні полімери амінокислот, а не розгалужені (як у деяких цукрів) ланцюжки, колоїди або циклоли.
Перші структури білків, засновані на методах рентгеноструктурного аналізу на рівні окремих атомів, були отримані в 1960-х роках, а за допомогою ЯМР-спектроскопії — в 1980-х роках. У 2006 році Банк даних білків (Protein Data Bank) містив біля 40 000 структур білків. В наш час кріоелектрона мікроскопія великих білкових комплексів за роздільною здатністю наближається до атомного рівня.
Особливістю досліджень білків початку 21-го століття є одночасне отримання даних про білковий склад цілих клітин, тканин або організмів — протеоміка. В результаті необхідності аналізу цих даних та росту можливостей обчислювальних технологій активно розвиваються методи біоінформатики аналізу та порівняння білкових структур та обчислювальні методи передбачення структури білків, наприклад, методи молекулярної динаміки, призначені замінити в майбутньому експериментальне визначення білкових структур.
Будова
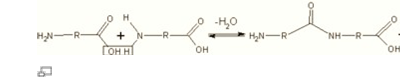
Схематичне зображення утворення пептидного зв'язку. Подібна реакція відбувається на рибосомі — молекулярній машині для складання білків.
Молекули білків є лінійними полімерами, що складаються з α-Lамінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот (щоправда модифікації відбуваються вже після синтезу білка на рибосомі). Для позначення амінокислот в науковій літературі використовуються одно- або трьохбуквені скорочення. Хоча на перший погляд може здатися, що використання «всього» 20 основних типів амінокислот обмежує різноманітність білкових структур, насправді кількість варіантів важко переоцінити: для ланцюжка всього з 5 амінокислот воно складає вже більше 3 мільйонів, а ланцюжок з 100 амінокислот (невеликий білок) може бути представлений більш ніж у 10130 варіантах (для порівняння — кількість атомів у Всесвіті оцінюється приблизно у 1080). Поліпептидні ланцюжки завдовжки від двох до кількох десятків амінокислотних залишків зазвичай називають пептидами, при більшому ступені полімеризації — власне білками або протеїнами, хоча цей поділ вельми умовний.
При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. Кінці білка називають С- і N- кінцями (залежно від того, яка з груп кінцевої амінокислоти вільна: -COOH чи -NH2, відповідно). При природному синтезі білка на рибосомі, нові амінокислоти приєднуються до C-кінця, тому назва пептиду або білка дається шляхом перерахування амінокислотних залишків починаючи з N-кінця.
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьох нуклеотидів — так званих кодонів. Те, яка амінокислота відповідає даному кодону в ДНК та мРНК (проміжній ланці біосинтезу білків), визначається генетичним кодом, який може дещо відрізнятися у різних організмів.
Гомологічні білки (що виконують одну функцію і мають загальне еволюційне походження, наприклад, гемоглобіни) різних організмів мають в багатьох місцях ланцюжка різні амінокислотні залишки, які називають варіабельними, на противагу консервативним, спільним залишкам. За ступенем гомології можна оцінити еволюційну відстань між таксонами, до яких належать всі організми
Рівні структури білків
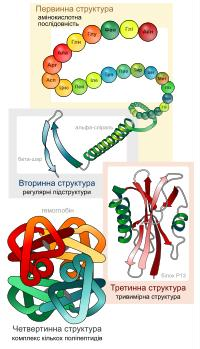
(Основні рівні структурної організації білків)
Первинна структура — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка.
Вторинна структура — локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають ] αспіралі (спіраль, що має 4 залишки на виток, стабілізована водневими зв'язками між пептидними групами з кроком у 4 ланки) і β-листи (кілька зигзагоподібних поліпептидних низок, в яких водневі зв'язки утворюються між відносно віддаленими ділянками ланцюжка або між різними ланцюжками, а не між близько розташованими пептидними групами, як це має місце для α-спіралі). Інші елементи вторинної структури включають π-спіралі (спіралі з кроком водневих зв'язків у 3 ланки), 310-спіралі (спіралі з кроком водневих зв'язків у 5 ланок), повороти, невпорядковані фрагменти та інші.
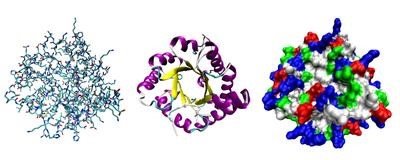
Приклади зображення тривимірної структури білків або їхніх фрагментів. Показаний білок — тріозофосфатізомераза — складається з восьми α-спіралей, розташованих на зовнішній поверхні й восьми паралельних β-листів всередині (так звана структура αβ-бареля, від англ. barrel — «бочка»). Ліворуч — «паличкова» модель, із зображенням всіх атомів і зв'язків між ними. Кольорами позначені різні атоми. В середині — зображення елементів вторинної структури — α-спіралей і β-листів. Кольорами позначені типи елементів. Праворуч — контактна поверхня білка, на підставі Ван дер Вальсових радіусів атомів. Кольорами позначені електростатичні властивості поверхні.
Третинна структура — повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків, солевих містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишками цистеїну.
До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка —
«надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка. Хоча структурні мотиви можуть бути аналогічними, частіше за все вони зберігаються в процесі еволюції видів. Домени — дещо більші елементи структури білка, що характеризуються стабілізацією незалежною від решти поліпептидного ланцюжка, і що часто виконують окрему функцію. В процесі еволюції елементи надвторинної структури можуть передаватися між генами, надаючи їм нові функції, таким чином існує набагато менше різновидів цих елементів, ніж різних білків. Процес передачі доменів можна здійснити і штучними методами генної інженерії, створюючи химерні білки
Четвертинна структура — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом.
Хімічні властивості
Білки також характеризуються ізоелектричною точкою (pH) — кислотністю середовища pH, при якому молекула даного білка не несе електричного заряду. Чим більше в даному білку гідроксильних груп (основних залишків), тим вище за нього pH. Білки з pH меншим за 7 називаються кислотними, а білки з pH більшим за 7 — основними. В цілому, pH білка залежить від функції, яку він виконує, так білки, що зв'язуються з нуклеїновими кислотами часто відносяться до основних білків. Прикладом таких білків служать гістони.
За ступенем розчинності у воді білки бувають розчинними (гідрофільними) і нерозчинними (гідрофобними). До останніх відносяться більшість білків, що входять до складу біологічних мембран, тобто інтегральних мембранних білків, які взаємодіють з гідрофобними ліпідами мембрани.,
Прості і складні білки
За складом виділяють прості і складні білки. Прості білки містять тільки амінокислоти, зв'язані в ланцюжки. На відміну від них складні білки мають також не амінокислотні групи. Ці додаткові групи у складі складних білків називаються простетичними групами. Деякі простетичні групи служать кофакторами, необхідними для роботи ферментів. Інші, такі як полісахаридні ланцюжки, допомагають білку приймати потрібну конформацію і додають додаткову стабільність. Прикладами органічних простетичних груп в складі білків служать гем (в складі гемоглобіну), тіамін, біотин та інші. Неорганічні простетичні групи найчастіше складаються з іонів металів, найпоширенішими з яких є цинк, магній і молібден. За типом простетичної групи складні білки поділяють на глікопротеїни, ліпопротеїни, хромопротеїни, нуклеопротеїни, фосфопротеїни, металопротеїни та деякі інші.Денатурація білків

Необоротна денатурація білка курячого яйця під впливом високої температури.
Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах (таких як pH, температура), до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Відомий випадок денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим.
Білки, що використовуються в технологічних методах і вимагають нетипових умов, часто підбираються з екстремофілів — організмів, здатних проживати в екстремальних умовах. Так, наприклад, ДНК-полімераза, що використовується в полімеразно-ланцюговій реакції (ПЛР), може витримувати без денатурації багаторазове нагрівання до 95 °C. Вона була спочатку виділена з бактерії Thermus aquaticus. Денатурація в деяких випадках оборотна, як, наприклад, при преципітації водорозчинних білків за допомогою солей амонію, і використовується як спосіб їхнього очищення.
Функції білків в організмі
Класифікація білків за функцією може бути як біохімічною, тобто за типом безпосередньої біохімічної функції, яку білок виконує в організмі, так і заснованою на головних клітинних процесах, один з кроків яких виконує даний білок. В останньому випадку класифікація включає такі категорії:
• Обробка та збереження інформації (процеси реплікації, експресії генів та підтримки геному).
• Клітинні процеси та сигнали (контроль клітинного циклу, підтримка структури клітини та органів, транспорт, модифікації макромолекул, сигнальні системи).
• Метаболізм (отримання та перетворення енергії, синтез та транспорт ліпідів, амінокислот, цукрів, неорганічних молекул, вторинних метаболітів).
У кожному організмі є невелика кількість білків, які виконують дві чи більше операцій. Найчастіше ці операції належать до одного функціонального блоку. Наприклад, лізил-тРНК-синтетаза ссавців є інформаційним білком, що приєднує лізин до тРНК і також регулює реплікацію ДНК і транскрипцію кількох генів, Білок CtrA бактерії Caulobacter crescentus контролює клітинний цикл через регуляцію реплікації і транскрипції. Аналіз геномів показав, що у різних організмів існує велика різниця у кількості білків, що виконують ту чи іншу функцію. Особливо це стосується операційних білків від яких залежить адаптація організму до його екологічної ніши. Цікаво, що у людини та деяких інших організмів частина білків не повністю закодована в унаслідованому геномі. Так, велика різноманітність імуноглобулинів досягається за рахунок рекомбінації та мутацій відповідних генів, що триває на протягу усього життя в клітинах імунної системи. Також не треба забувати, що виявлення функцій білків ще не закінчилося: у будь якому організмі 20% чи більше білків виконують функції, про які ще нічого не відомо.
Каталітична функція
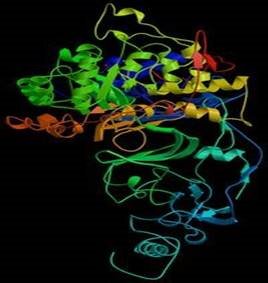
Стрічкова молекулярна модель ферменту уреази бактерії H. pylori.
Найкраще відома роль білків в організмі — каталіз різних хімічних реакцій.
Ферменти — тип білків, що характеризується специфічними каталітичними властивостями, тобто кожний фермент каталізує одну або декілька реакцій. Ферменти каталізують реакції розщеплювання (катаболізм) і синтезу (анаболізм) складних молекул, зокрема, синтез та деградацію ДНК, РНК, білків, ліпідів та цукрів. Крім того вони каталізують синтез та деградацію малих молекул, хімічні модифікації та ряд інших реакцій, необхідних для життєдіяльності. Відомо біля 4 тис. реакцій, що каталізуються ферментами, багато з них протікають поза межами клітин[32], наприклад фермент пепсин розщеплює білки в процесі травлення. Прискорення реакції в результаті ферментативного каталізу часто величезне: наприклад, реакція, що каталізується ферментом оротат-карбоксилазою протікає в 1017 разів швидше, ніж без каталізатора (реакція відбувалася б раз у 78 мільйонів років без ферменту, і відбувається раз у 18 мілісекунд за участю ферменту). Молекули, які змінюються в результаті реакції при посередництві ферментів, називаються субстратами.
Хоча ферменти зазвичай складаються з сотень амінокислот, тільки невелика частина з них взаємодіє з субстратом, і ще менша кількість — в середньому 3-4 амінокислоти в одній молекулі білка, часто розташовані далеко одна від іншої в первинній амінокислотній послідовності, — безпосередньо беруть участь в каталізі. Частина ферменту, яка з'єднується із субстратом і містить каталітичні амінокислоти, називається активним центром ферменту.
Структурна функція
Структурні білки часто грають роль арматури, що надає форму та жорсткість клітинам та тканинам. Зазвичай ці білки здатні формувати довгі філаменти або зв'язувати філаменти, сформовані іншими білками — частина структурних білків є фібрилярними, інші формують філаменти за допомогою полімеризації глобул білка за певних умов. Структурну роль всередині клітини грають компоненти цитоскелету: наприклад глобулярні актин і тубулін в еукаріотів та їхні бактеріальні гомологи. Ці білки дуже динамічні, тобто можуть полімеризуватися при потребі. Вони відіграють роль не тільки у забезпеченні структури, але й у локомоції клітин та клітинному поділі. Інші компоненти цитоскелету — проміжні філаменти еукаріотів та бактеріальний кресцентин — фібрилярні й мають перш за все структурну функцію. Важлива також структурна роль компонентів міжклітинної матриці. Деякі з них збираються в значних кількостях і відіграють роль у забезпеченні структури окремих органів, наприклад, міжклітинний кератин важливий для підтримки структури волосся, нігтів і пір'я птахів. Колаген, ламінін і еластин важливі для підтримки епітелію стінок порожнин організму — легенів, шлунка, тощо. Крім того, колаген і еластин — основні компоненти сполучної тканини (наприклад, хряща). Структурні білки також складають клітинну стінку багатьох архей і відіграють роль в утриманні разом полісахаридних компонентів клітинних стінок рослин та бактерій.
Захисна функція
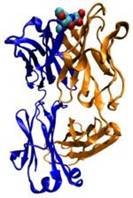
Багато білків, що входять до складу крові, беруть участь в захисній відповіді організму як на пошкодження, так і на атаку патогенів. Прикладами першої групи білків служать фібриногени і тромбіни, що беруть участь в згортанні крові, а антитіла (імуноглобуліни), нейтралізують бактерії, віруси або чужорідні білки. Антитіла, що входять до складу адаптативної імунної системи, приєднуються до чужорідних для даного організму речовин, антигенів, і таким чином нейтралізують їх, направляючи до місць знищення. Антитіла можуть секретуватися в міжклітинний простір або закріплюватися в мембранах спеціалізованих В-лімфоцитів, які називаються плазмоцидами.
Принципово іншим класом захисних білків (зазвичай пептидів) є токсини, що використовуються багатьма організмами для знищення хижаків і паразитів, тоді як власні клітини захищені від токсинів фізичним бар'єром, містять антидот (протиотруту), що локально нейтралізує токсин, або нечутливі до нього через іншу будову, ніж клітини жертви токсинів.
Захист кліток від токсинів, шкідливих хімічних речовин з навколишнього середовища й продуктів власного метаболізму, а також багатьох фармацевтичних препаратів може здійснюватися мембранними білкаминасосами. Різноманітність, специфічність і принцип дії таких білків-насосів, відкачуваючих шкідливі речовини із кліток, сильно варіює від організму до організму.
Широко розповсюдженим способом захисту бактерій від бактеріофагів є система рестрикції-модифікації. Один білок цієї системи метилює певні сайти знову синтезованої геномної ДНК бактерій. Інший білок — рестриктаза розщеплює незахищену ДНК бактеріофагів. Існує багато інших способів і відповідних їм білків для захисту бактерій від фагів і еукаріотичних кліток від ДНКових і РНКових вірусів і бактерій.
Сигнальна та регуляторна функція
Багато білків беруть участь в процесах передачі сигналів на міжклітинному та внутрішньоклітинному рівнях. До прикладів таких білків належить гормон інсулін, який регулює концентрацію глюкози в крові та фактор некрозу пухлин, що передає сигнали про запалення між клітинами організму. Інші молекули, залучені до сигнальної системи, — рецептори, що можуть бути як мембранними, так і цитоплазматичними або периплазматичними білками. Одна частина молекули рецептора сприймає сигнал, який з допомогою конформаційних змін передається на іншу частину молекули, що активує передачу сигналу на інші клітинні компоненти.
Багато внутрішньоклітинних сигнальних білків організовані в сигнальні каскади, ланки яких модифікують наступний білок за допомогою ковалентних модифікацій (наприклад, фосфорилювання за допомогою білкових кіназ) або зв'язування. Ці каскади передають сигнал про зміну умов навколишнього середовища або внутрішньоклітинні процеси на регуляторні білки, які в свою чергу регулюють клітинну відповідь.
Транспортна функція
Розчинні білки, що беруть участь в транспорті малих молекул, зв'язують відповідний субстрат в одній частині клітини або організму, наприклад в місцях високої концентрації або при присутності додаткових регуляторних факторів, і легко вивільняють його в місцях низької концентрації субстрату або там, де відсутні згадані регуляторні молекули. Прикладом таких транспортних білків можна назвати гемоглобін, який переносить кисень з легень до решти тканин і вуглекислий газ від тканин до легень, а також гомологічні йому білки, знайдені у представників інших доменів живих організмів
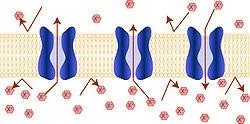
Схематичне зображення іонних каналів в мембрані клітини
Деякі мембранні білки беруть участь в транспорті малих молекул через біологічні мембрани, змінюючи їхню проникність для цих молекул. Ліпідний компонент мембрани водонепроникний (гідрофобний), що запобігає дифузії полярних або заряджених (іони) молекул. Ці мембранні білки містять внутрішні канали, які дозволяють таким молекулам переміщатися всередину або назовні, та мають можливість відкривати або закривати їх за певними умовами. Багато іонних каналів спеціалізується на транспорті тільки одного іона, так калійні і натрієві канали розрізняють ці схожі йони і пропускають тільки один з них.
Ще однією життєво важливою білковою транспортною системою є електронтранспортний ланцюг, необхідний у процесах фотосинтезу та клітинного дихання. В результаті роботи цієї системи, електрони переносяться через мембрану проти електричного поля за рахунок енергії світла або катаболічної енергії, що отримується в циклі Кребса та при окисленні білків і ліпідів. Енергія, збережена у формі різниці електрохімічних потенціалів, використовується іншим білковим комплексом, АТФ-синтазою, для перетворення цієї енергії на АТФ, форму, зручну для використання іншими білками клітини.
Моторна функція
Функцією молекулярних моторів є здійснення механічної роботи в межах клітини за рахунок хімічної або електричної Моторні білки динеїни і кінезини транспортують молекули та органели вподовж мікротрубочок з використанням гідролізу АТФ як джерела енергії. Динеїни переносять вантаж із цитоплазми у напрямку до центросоми, кінезини в протилежному напрямку. Ця активність важлива як для розділення хромосом в анафазі мітозу при клітинному поділі, так і для доставлення важливих молекул до місць їхнього використання, часто дуже віддалених, як це відбувається при аксоплазматичному транспорті. Інші моторні білки важливі для життєвих процесів біосинтезу білків, зокрема розплітанні ДНК (топоізомерази) та русі білкових комплексів уздовж ДНК (полімерази) та РНК (рибосоми).
Запасна (резервна) функція
У деяких системах класифікації виділяється окрема група білків, що виконують, головним чином, резервну і харчову функцію. Проте, майже усі білки використовуються в організмі як джерело амінокислот. Твердження, що резервна є головною функцією якогось білка може виявитися не обґрунтованим просто через недолік знань. Наприклад, вивчення овальбуміна (основного компонента яєчного білка) показало, що він не тільки служить джерелом сировини, але також бере участь в транспорті іонів металів і може відігравати захисну роль, викликаючи алергію у тварин, у тому числі в людини.
Ліпіди — це низькомолекулярні речовини з гідрофобними властивостями. Разом з білками і вуглеводами це основні компоненти всіх видів клітин. У різних органах і тканинах вміст ліпідів неоднаковий. Особливо багато їх у нервовій тканині, серці, печінці, нирках, крові, насінні і плодах деяких рослин.
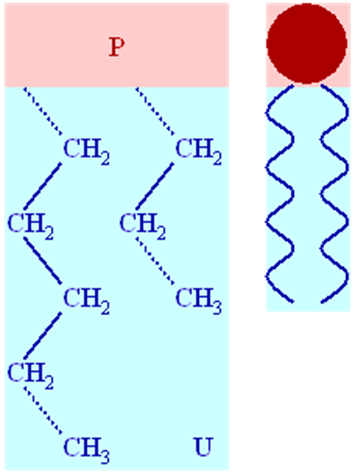
Рис. 1. Структура ліпідів
Ліпіди - органічні сполуки, гідрофобні, їх можна виділити з клітин за допомогою неполярних розчинників (ефіру, хлороформу, ацетону тощо). Ліпіди здатні утворювати складні сполуки з білками, вуглеводами, залишками фосфатної кислоти тощо.
Класифікація ліпідів
Прості ліпіди
Тригліцериди
Воски
Складні ліпіди (основні класи)
Фосфоліпіди
Гліколіпіди
Основні функції
енергетична - у разі повного окиснення 1 г жирів до вуглекислого газу і
води виділяється 38.9 кДж енергії. будівельна - фосфоліпіди є основою клітинних мембран, входять до
складу нервових волокон і т.д.
захисна - захищають внутрішні органи людини від механічних
пошкоджень теплоізоляційна - запобігають переохолодженю
видільна - у жировому тілі комах можуть накопичуватися кінцеві
продукти обміну речовин регуляція життєвих функцій - беруть участь у обміні речовин хребетних
тварин
За хімічною будовою ліпіди досить різноманітні. До складу їхніх молекул входять вищі жирні кислоти, спирти, альдегіди, азотисті основи, амінокислоти, аміноспирти, вуглеводи, фосфорна кислота та ін. Між цими сполуками можуть утворюватися зв'язки: ефірні, складноефірні, глікозидні, амідні, фосфоефірні тощо. Класифікація ліпідів дуже складна у зв'язку зі складністю будови молекул цих речовин та їх різноманітністю. Нині всі ліпіди прийнято поділяти на нейтральні (жири) і фосфоліпіди.
Нейтральні ліпіди — це похідні вищих жирних кислот і трьохатомного спирту гліцерину. Як і вуглеводи, жири використовуються як джерело енергії: під час розщеплення одного грама жиру виділяється 38,9 кДж енергії. Підшкірний жир виконує важливу теплоізоляційну функцію, а також сприяє зменшенню впливу ударів та поштовхів. Для тварин, які впадають у сплячку, жири забезпечують організм необхідною енергією, оскільки поживні речовини ззовні в цей час не надходять. Жири становлять запас поживних речовин і в насінні багатьох рослин.
Фосфоліпіди — найбільша частина ліпідів, які входять до складу клітинних мембран. Якщо в середньому на ліпіди припадає 40 % сухої маси мембран, то 80 % з них — на фосфоліпіди. Отже, основні функції мембран (регулювання проникності різних речовин і клітинного вмісту, функціонування іонних насосів, сприйняття, оброблення і передавання всередину клітини інформації з її поверхні, імунна відповідь, синтез білків і багато іншого) здійснюються за участю фосфоліпідів.
Ліпіди не розчинні у воді і добре розчинні в органічних розчинниках (бензині, ефірі тощо). Самі ліпіди є розчинниками для деяких вітамінів.
Ліпіди займають у клітині 5–15% сухої речовини. Ліпіди — це похідні вищих жирних кислот і багатоатомних спиртів або альдегідів. Розрізняють нейтральні жири (триацилгліцериди жирних кислот) і ліпоїди (фосфатиди, цереброзиди, мієлін).
Серед ліпоїдів розповсюдженим є холестерин, особливо в клітинах надниркових залоз і печінки, а також у клітинних мембранах.
До ліпоїдів належать і фосфатиди (лецитин, цефалін, інозид, плазмалоген), які так само беруть участь у побудові клітинних мембран.
Біологічне значення жирів і ліпоїдів. Ліпіди виконують дуже важливу роль в утворенні біологічних мембран, беруть участь в енергетичній функції клітини, а також у стабілізації постійності внутрішнього середовища клітин і організму.

Рис. 2. Структура ліпідів:
(а) нейтрального жиру (тригліцериду) жирних кислот) і (б) ліпоїду холестерину Вуглеводи
Вуглеводи — органічні сполуки з емпіричною формулою Cm(H2O)n, до складу яких входять тільки Вуглець, Кисень та Водень. Вуглеводи є складовою частиною клітин усіх живих організмів.
Вуглеводи є найпоширенішими органічними сполуками, що підтверджується тим фактом, що більше половини органічного вуглецю на Землі існує у формі вуглеводів.
Здебільшого вуглеводи є сполуками рослинного походження — це продукти фотосинтезу і таким чином вони є базовою ланкою у трансформації сонячної енергії у хімічну для забезпечення життя на Землі.
Поряд з білками і жирами, вуглеводи — важлива складова частина харчування людини і тварин, багато з них використовується як технічна продукція.
З хімічної точки зору це є полігідроксикарбонільні сполуки та їхні похідні із загальною формулою СnH2nOn.
Низькомолекулярні вуглеводи відомі також як цукри.
Найвідомішими представниками вуглеводів є целюлоза, крохмаль,
глюкоза 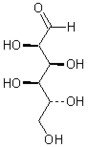 , фруктоза
, фруктоза 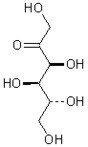 ,
,
цукроза (звичайний цукор)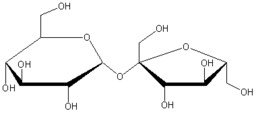 .
.
Вуглеводи поділяють на моносахариди, дисахариди, олігосахариди і полісахариди.
Поширена в природі група багатоатомних спиртів (цукрів, целюлози, крохмалю тощо). У вищих рослинах вуглеводів міститься більше, ніж інших речовин. Деревина, наприклад, містить понад 50% найскладніших вуглеводів, до яких належить целюлоза, причому її супроводжують менш складні прості вуглеводи, пектинові речовини й геміцелюлози.
Прості вуглеводи. До цієї групи вуглеводів належать розчинні в холодній воді найпростіші моносахариди — гексози С6Н12О6 і пентози С5Н10О5. Пентози поширені в рослинах, входять до складу речовини клітин.
Харчова енергетична цінність вуглеводів складає приблизно 4 ККал/грам Особлива група органічних сполук-це біологічно-активні речовини. Вони впливають на процеси обміну речовин і перетворення енергії в живих організмах.
Залежно від числа кисневих атомів у молекулі розрізняють біози, тріози, тетрози, пентози, гексози, гептози і т. д.
Вуглеводи у великій кількості містяться в рослинних і тваринних організмах. У природі переважно поширені пентози і гексози.
Моносахариди
Моносахариди — прості вуглеводи, вони не піддаються гідролізу — не розщеплюються водою на простіші вуглеводи. Глюкоза і виноградний цукор, С6Н12О6 - найважливіші з моносахаридів; білі кристали солодкі на смак, легко розчиняються у воді. Знаходяться в соку винограду, в багатьох фруктах, а також у крові тварин і людей. М'язова робота виконується головним чином за рахунок енергії, яка виділяється при окисленні глюкози. Глюкоза отримується при гідролізі полісахаридів крохмалю і целюлози (під дією ферментів або мінеральних кислот). Використовується як засіб посиленого харчування, або як лікарська речовина, при обробці тканини.
Фруктоза, чи плодовий цукор, С6Н12О6-моносахарид, супутник глюкози в багатьох плодах і ягідних соках; значно солодше глюкози; в купі з нею входить до складу меду. Представляє собою шестиатомний кето спирт. В формулах фруктоз і глюкози показано характерне для цих моносахаридів відносне просторове положення атомів Н і групи ОН які входять у вуглеводний ланцюжок.
Моносахариди, як альдегіди чи кето спирти являються зв'язками зі змішаними функціями; природа їх ускладнена властивістю внутрішньо молекулярних взаємодій спиртових гідроксильних груп з альдегідної чи кетонової карбонільної групи. Завдяки цьому моносахариди існують і вступають в реакцію не тільки у відкритій ланцюговій формі, але й в циклічних формах. Вуглеводний ланцюжок моносахариду, наприклад глюкози, може приймати конформацію, при цьому 1-й С-атом, несучий карбонільну групу, зближується із спиртовою групою при 5-м С-атомі;атом Н із групи ОН переміщується до карбонільного кисню, а кисень при 5-м С-атомі з'єднується з 1-м (карбонільним) С-атомом. В наслідок замикається шестичленне, зміст атомів кисню, кільце. Так утворюються дві циклічні А і В-форми глюкози відрізняючись просторовим розташуванням атомів Н і групи ОН при 1-му (циклі він стає асиметричним) С-атомі.
У формулах циклічних форм показано, що можливий зворотній перехід атому Н з групи ОН при першому С-атомі до кисню кільця. Останнє при цьому розкривається і утворюється ланцюгова форма.
Природна кристалічна глюкоза (виноградний цукор) представляє собою циклічну альфа-формулу. При розчиненні в воді вона переходить в ланцюгову, а через неї в бета-форму; при цьому установлюється динамічна рівновага між усіма формами. Бета-форма також може бути виділена в кристалічному вигляді; в водному розчині вона утворює рівноважну систему, яка має всі форми. Ланцюгова форма існує лише в розчинах, причому в дуже невеликій кількості, а в вільному вигляді не виділена. Ізомерні форми сполук, які здатні переходити один в одного називають таутомерними формами, чи таутомерами. А саме існують їх явища таутомерії. Вона дуже розповсюджена серед органічних сполук.
Дисахариди
Дисахариди — вуглеводи, які при нагріванні з водою в присутності мінеральних кислот чи під дією ферментів піддаються гідролізу, розкладаються на дві молекули моносахаридів.
Буряковий та тростинний цукор (сахароза), С12Н22О11 — важливіший із дисахаридів. Добувається із цукрового буряку (в ньому знаходиться до 28% сахарози від сухої речовини) чи із цукрової тростини; знаходиться в соку берези, клену і деяких фруктах. Сахароза — цінний харчовий продукт. При гідролізі він розпадається з утворенням молекули глюкози і молекули фруктози.
Полісахариди
Полісахариди — це вуглеводи, які багато в чому відрізняються від моносахаридів і дисахаридів і не мають солодкого смаку, і майже не розчинні в воді. Вони представляють собою складні високомолекулярні сполуки, які під каталітичним впливом кислот чи ферментів піддаються гідролізу з утворенням простіших поліцукридів, потім дицукридів, і, зрештою, багато (сотні і тисячі) молекул моноцукридів. Важливіший представник поліцукрів — крохмаль і целюлоза. Їхні молекули побудовані із ланок -С6Н10О5-, є залишками шестичленних циклічних форм молекул глюкози, без молекули води, тому склад крохмалю і целюлози виражається однією формулою (С6Н10О5).
Крохмаль (С6Н10О5) білий під мікроскопом зернистий порошок, нерозчинний в холодній воді, в гарячій воді набухає, утворює колоїдний розчин (крохмальний клейстер); з розчином йоду дає синє забарвлення. Молекула крохмалю неоднорідна за розмірами. Крохмаль утворюється в результаті фотосинтезу в листі рослин, відкладається «про запас» в кореневищах, зернах. В шлунковому тракті людини і тварини крохмаль піддається гідролізу і перетворюється в глюкозу, яка засвоюється організмом.
В техніці перетворення крохмалю в глюкозу (процес оцукрювання) відбувається шляхом кипіння його впродовж декількох годин із розбавленням сірчаної кислоти (каталітичний вплив сірчаної кислоти на оцукрювання крохмалю було винайдено в 1811 р. російським вченим К. С. Кирхгофом). Щоб з утвореного розчину вилучити сірчану кислоту до нього добавляють крейду, утворюючи з сірчаної кислоти нерозчинений сульфат кальцію. Останній відфільтровують і речовину упарюють. Утворюється густа солодка маса — крохмальна патока, що крім глюкози містить значну кількість інших продуктів гідролізу крохмалю. Патока використовується для приготування кондитерських виробів і для різноманітних технічних цілей. Якщо потрібно отримати чисту глюкозу, то кип'ятіння крохмалю ведуть довше, ніж досягається повніше перетворення його на глюкозу. Отримання після нейтралізації і фільтрування розчин згущають, поки з нього не почнуть випадати кристали глюкози. При нагріванні сухого крохмалю до 200—250°С відбувається часткове розкладання його і отримується суміш менш складних ніж крохмаль, полісахариди називаються декстрином. Декстрин використовується для оздоблення тканин і приготування клею. Перетворення крохмалю в декстрин пояснюється утворенням підсмаженої корки на випеченому хлібі, а також блиск накрохмаленої білизни.
Контрольні питання:
1. Які хімічні сполуки належать до органічних?
2. Яка роль органічних речовин у природі?
3. Що таке ліпіди?
4. Які сполуки належать до ліпідів?
5. Які функції ліпідів у живих організмах?
6. У яких клітинах і тканинах відкладається найбільше ліпідів?
7. Що таке білки?
8. Які функції білків в організмі?
9. Охарактеризуйте будову білків у клітині. Як утворюються первинна, вторинна і третинна структура білка?
10. Охарактеризуйте будову і біологічне значення вуглеводів і жирів у клітині.
11. Яке значення білків у клітині і в організмі ?
Матеріали активізації
1. До класу органічних сполук належать целюлоза та глікоген
А .полісахариди
Б .полінуклеотиди
В .моносахариди
Г .дисахариди
2. Укажіть вуглевод, що не розчиняється у воді і не має солодкого смаку. А глюкоза
Б мальтоза
В фруктоза
Г целюлоза
3.Який з перелічених білків має четвертинну структуру?
А альбумін крові
Б кератин волосся
В фіброїн шовку
Г гемоглобін крові


про публікацію авторської розробки
Додати розробку
