Атоми і молекули. Будова атома. Наноматеріали.
Тема уроку: Атоми і молекули. Будова атома. Наноматеріали.
Мета уроку:
навчальна – систематизація знань про масу та розміри атомів і молекул, кількість речовини;
продовження формування навичок і вмінь здобувачів освіти розв’язувати типові фізичні задачі;
розвивальна – розвивати увагу, творчі здібності здобувачів освіти, вдосконалювати вміння застосовувати набуті знання на практиці;
виховна – виховувати почуття відповідальності, взаємодопомоги, вміння виступати перед аудиторією.
Тип уроку: урок засвоєння нових знань.
Обладнання: підручник, ноутбук, проектор, мультимедійна дошка, інтернет – мережа, презентація до уроку, крейда, губка, додаток.
Міжпредметні зв’язки: хімія, математика, інформатика, біологія та технологія.
План – схема уроку
|
№ |
Етапи уроку |
Час, хвилини |
Методи і форми роботи з групою |
|
1. |
Організаційний етап |
1 |
|
|
2. |
Повідомлення теми, мети і завдань уроку |
2 |
Визначення мети уроку за планом вивчення теми |
|
3. |
Актуалізація опорних знань |
5 |
Фронтальне опитування |
|
4. |
Сприймання і первинне осмислення нового матеріалу |
20 |
Розповідь вчителя з елементами бесіди в супроводі презентації |
|
5. |
Запитання на закріплення нового матеріалу |
8 |
Фронтальне опитування |
|
6. |
Підведення підсумків уроку |
2 |
|
|
7. |
Домашнє завдання |
2 |
Пояснення, інструктаж викладача |
Хід уроку
- Організаційний етап.
Забезпечити робочу обстановку на уроці, створити сприятливий психологічний клімат:
- привітання;
- перевірка готовності здобувачів освіти до уроку;
- перевірка відсутніх здобувачів освіти.
- Повідомлення теми, мети і завдань уроку.
Сьогодні ми з вами продовжуємо вивчати розділ молекулярної фізики і термодинаміки.
Отже, тема сьогоднішнього уроку – Атоми і молекули. Будова атома. Наноматеріали.
(Учні записують тему в зошит).
Оголошую мету уроку – розглянути масу і розміри молекул, кількість речовини, навчитися визначати молярну масу деяких речовин.
Епіграф уроку: «Не існує нічого, крім атомів. Демокріт».
Зверніть у вагу на план вивчення теми.
План вивчення теми: 1. Атоми і молекули;
2.Будова атома;
3.Наноматеріали.
3. Актуалізація опорних знань.
Перед початком вивчення нової теми я пропоную вам відповісти на декілька запитань, які стосувалися попередньої теми.
- Що вивчає молекулярна фізика? (Молекулярна фізика – це розділ фізики, який вивчає будову, фізичні властивості й агрегатні стани речовини на основі їх мікроскопічної (молекулярної) будови.
- Які бувають агрегатні стани речовини? (Усі речовини можуть знаходитися в трьох агрегатних станах: твердому, рідкому та газоподібному).
- Речовина, яку на Землі можна зустріти в усіх трьох станах? (Вода).
- Вивчення нового матеріалу.
- Атоми і молекули.
Отже, ми з вами повторили, що молекулярна фізика – це розділ фізики, який вивчає будову, фізичні властивості й агрегатні стани речовини на основі їх мікроскопічної (молекулярної) будови.
Усі речовини складаються з частинок – атомів, молекул, йонів, тобто мають дискретну будову; між частинками є проміжки. А, що таке дискретність – це властивість роздільності, перервності.
Атом (з грецької «неподільний») – це найменша частина хімічного елемента, яка є носієм його властивостей та не ділиться в процесі хімічних реакцій.
«Увесь світ складається з атомів та пустоти», вважав давньогрецький філософ Демокрит.
Кожному хімічному елементу відповідає певний атом, який позначають символом елемента (атом Гідрогену H, атом Карбону C, атом Оксигену O).
Атом має складну структуру та являє собою ядро, оточене хмарою електронів. Кількість електронів в атомі дорівнює кількості протонів у його ядрі. Заряд електрона за модулем дорівнює заряду протона, тому атом є електрично нейтральним. Об’єднуючись , атоми утворюють молекули.
Молекула – це найменша стійка частинка речовини, яка має її основні хімічні властивості та складається з атомів одного (проста речовина) або кількох (складна речовина) хімічних елементів.
Зауваження. Атом можна розглядати як одноатомні молекули.
Молекули різних речовин мають різний атомний склад. Усе величезне розмаїття речовин зумовлене різними сполученнями атомів і молекул.
Іон – атом або молекула, який має електричний заряд. Якщо іон має позитивний заряд , його називають катіоном, а якщо від’ємним – аніоном. У вигляді самостійних частинок іони зустрічаються у всіх агрегатних станах речовин: газах, рідинах, твердих станах та у плазмі.
Якщо атом або молекула втратили один або кілька електронів, вони стають позитивним йоном; якщо ж до атома (молекули) приєднались один або кілька електронів, утворюється негативний йон.
Розміри молекул настільки малі, що це важко уявити. Якщо молекулу води (d ≈ 3×10-10 м) збільшити в мільйон разів, то вона матиме розмір крапки (≈ 0,3 мм). Зрозуміло, що й маси атомів і молекул теж малі (порядку 10-26 кг). Вимірювати їх у таких одиницях, як кілограм, дуже незручно, тому було впроваджено позасистемну одиницю – атомну одиницю маси, яка дорівнює 1/12 маси атома Карбону 12 6C:
1 а.о.м. = 1/12 mо (12 6C) ≈ 1,66 × 10-27кг
Масу молекули (атома), подану в атомних одиницях маси, називають відносною молекулярною (відносною атомною) масою Mr:
Mr = mo/1/12mo(12 6C)
Відносна молекулярна маса показує, у скільки разів маса mo молекули більша, ніж 1/12 маси атома Карбону 12 6C.
Макроскопічні тіла складаються з величезного числа частинок. Визначимо, наприклад, кількість молекул у склянці води (m = 0,2 кг). Маса молекули води mo ≈ 3, 0 × 10-26 кг. Отже, у склянці води міститься: N = m/mo ≈ 7×1024 молекул. Рахуючи таку величезну кількість мікрочастинок певними «порціями» - молями. В одному молі будь – якої речовини міститься однакова кількість атомів або молекул, - стільки, скільки атомів Карбону місти ться у вуглеці масою 12 г. Це число має назву стала (число) Авогадро:
NA ≈ 6,02 × 1023 моль-1.
Фізична величина, яка дорівнює кількості молів частинок речовини, називається кількістю речовини ᵥ : ᵥ = N/NA ,
де N – число частинок речовини, NA – стала Авогадро.
Одиниця кількості речовини в СІ – моль:
[ᵥ] = 1 моль.
Маса даної речовини, узятої в кількості 1 моль (6,02 × 1023 молекул), називається масою М речовини:
M = mo × NA,
де mo - маса молекули (атома) даної речовини.
Одиниця молярної маси в СІ – кілограм на моль:
[M] = 1 кг/ моль.
- Молярна маса дорівнює відносній молекулярній масі, поданій у грамах:
M = Mr × 10-3 кг/моль
- Кількість речовини масою m і молярною масою M можна визначити за формулою:
ᵥ = m/M
- Число N молекул речовини дорівнює:
N = m/M × NA
Відношення числа молекул N до об’єму V, який займають ці молекули, називається концентрацією молекул і позначають n:
n = ![]() ,
,
Концентрація молекул вимірюється в 1/м3.
- Будова атома.
Першу модель атома запропонував Дж. Томсон у 1903 році. Атом він уявляв як певну кількість позитивно зарядженої речовини – «тіло атома», у яку вкраплені негативно заряджені електрони (як родзинки у булку).
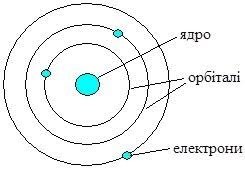
Будова атома.

Однак, планетарна модель атома Резерфорда мала певні недоліки. Одним з найочевидніших було те, що при обертанні електрон має втрачати енергію і наближатись до ядра, врешті-решт впавши на нього, що призвело б до зникнення атома. Однак цього ніколи не відбувається.
Для усунення цієї та деяких інших суперечностей, Н. Бор (1913 р.) запропонував доповнити теорію будови атома Резерфорда постулатами (положення, які приймають без доведення):
- електрон може рухатись навколо ядра лише по певних колових – стаціонарних – орбітах;
- рухаючись по стаціонарній орбіті електрон не випромінює і не поглинає енергію.
Такі уявлення про будову атома були близькими до сучасних.
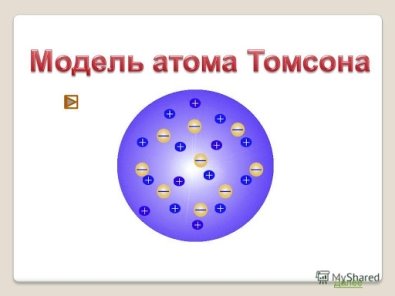
- Наноматеріали.
Нанотехнології — технології розроблення продуктів і компонентів, розмір яких не перевищує 100 нанометрів (один нанометр дорівнює мільярдній частині метра: 1 нм = 1·10–9 м).
Молекули різних речовин по-різному взаємодіють одна з одною. Така взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру 6 руху та взаємодії молекул розрізняють такі стани речовини: твердий, рідкий, газоподібний, плазма.
Безперервним хаотичним рухом молекул та майже відсутньою силою притягання пояснюється здатність газів необмежено розширюватися і займати весь наданий їм об’єм. Пружність газів, твердих тіл і рідин, здатність рідин змочувати тверді тіла, процеси фарбування, склеювання, деформації твердих тіл тощо також свідчать про існування сил притягання і відштовхування між молекулами. Довести існування значних сил притягання між атомами або молекулами твердих тіл можна, зокрема, за допомогою досліду з товстою палицею, яку складно зламати.
Розвиток нанотехнологій став можливим після відкриття фулеренів – нової алотропної модифікацї атома Карбону(1985 р.). Властивість Карбону утворювати надтонкі матеріали і стало основою сучасних нанотехнологій.
Графен – штучно отримана гексагональна модифікація (2004 р.) з одноатомного шару Карбону. Його міцність на порядок вища за міцність будь-якої відомої науці речовини. Має надзвичайну електропровідність.
Галузі нанотехнологій:
• Наноелектроніка
• Наномеханіка
• Спінтроніка
• Нанооптика
• Наносенсорика
• Нанобіологія
• Наномедицина
Учимося розв’язувати задачі.
Задача 1. Скільки вільних електронів міститься в алюмінієвому бруску розмірами 1× 4× 5 см? Вважайте, що кожний атом Алюмінію дає один вільний електрон.
![]()
![]() Аналіз фізичної проблеми. За умовою задачі кількість електронів дорівнює числу атомів Алюмінію у бруску об’ємом 20 см3 (1× 4× 5 см). Молярну масу алюмінію знайдемо, скориставшись Періодичною системою хімічних елементів: M = Mr × 10-3 кг/моль = 27 × 10-3 кг/моль. Густину алюмінію знайдемо в таблиці густин.
Аналіз фізичної проблеми. За умовою задачі кількість електронів дорівнює числу атомів Алюмінію у бруску об’ємом 20 см3 (1× 4× 5 см). Молярну масу алюмінію знайдемо, скориставшись Періодичною системою хімічних елементів: M = Mr × 10-3 кг/моль = 27 × 10-3 кг/моль. Густину алюмінію знайдемо в таблиці густин.
![]()
![]() Дано: СІ Розв’язання:
Дано: СІ Розв’язання:
V = 20 см3 20×10-6м3 N = ![]() × NA , де m = ρV – маса Алюмінію.
× NA , де m = ρV – маса Алюмінію.
M = 27 × 10-3кг/моль Остаточно маємо: N = ![]() NA =
NA = ![]() .
.
ρ = 2,7 × 103 кг/м3 Перевіримо одиницю, знайдемо значення шуканої величини :
![]() NA ≈ 6,02 × 1023 моль-1 [N] =
NA ≈ 6,02 × 1023 моль-1 [N] = ![]() = 1;
= 1;
N - ? N = ![]() = 12 .
= 12 . ![]() .
.
Відповідь: N = 12 . ![]() .
.
Задача 2. Визначте, яку масу мають 50 молів вуглекислого газу CO2.
Задача 3. Визначте у молях кількість речовини, яка міститься у 200 г води.
- Запитання на закріплення матеріалу.
- Усі речовини з яких частинок складаються?
- Що таке атом?
- Що таке молекула?
- Що таке іон?
- Дайте визначення для кількості речовини.
- Чому дорівнює стала Авогадро.
- Підведення підсумків уроку.
- Домашнє завдання: конспект.
За наявності часу даємо здобувачам освіти можливість розглянути нанофотографії різноманітних органічних та неорганічних речовин. Наприклад,
|
|
Яєчна шкаралупа |
|
|
Яйця божої корівки |
|
|
Око комахи |
|
|
Людський зуб |
|
|
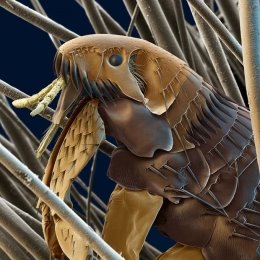
Блоха в котячій шерсті |
|
|
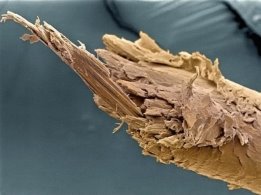
Людська волосина |
|
|
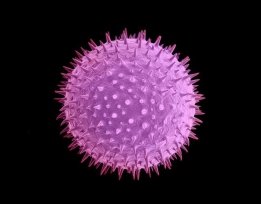
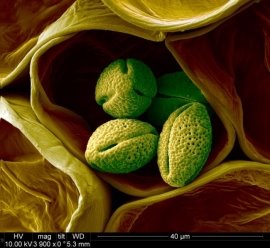
Пилок польової мальви |
|
|
Пилок фіалки |
|
|
Листок м’яти |
|
|
Тихохідка – саме життєздатне створіння на планеті, витримує температуру -271⁰С і температуру кипіння води; виживає навіть у космосі. |


про публікацію авторської розробки
Додати розробку