Електричний струм в напівпровідниках

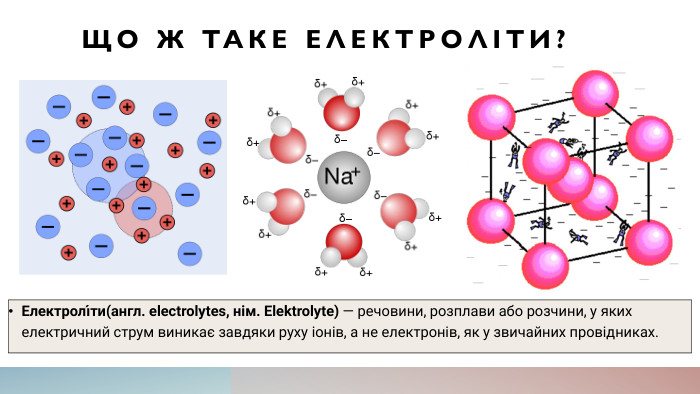



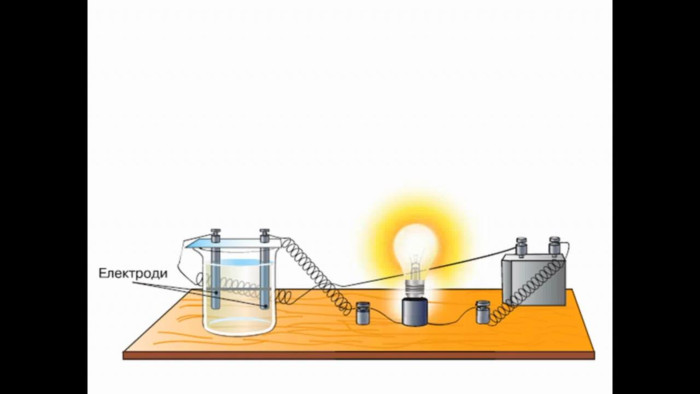







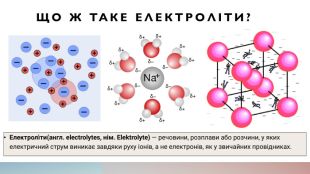
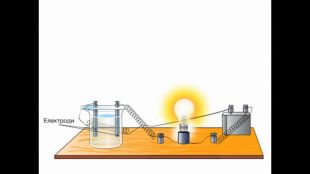
Як електричний струм проходить через електроліти?Електричний струм проходить через електроліти за допомогою іонів, які є зарядженими частинками. Коли підключається джерело електричної енергії до електродів, відбувається процес окислення та редукції, під час якого іони переміщуються від одного електрода до іншого через електроліт. Іони можуть бути додатньо зарядженими (катіони) або від'ємно зарядженими (аніони), і вони рухаються в напрямку, протилежному до заряду, який вони несуть. Цей рух іонів створює електричний струм, який можна виміряти за допомогою амперметра.
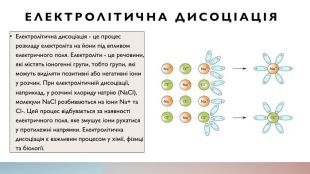
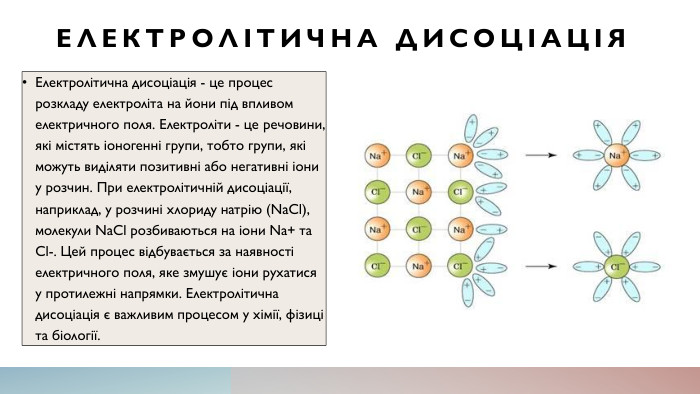
Електролітична дисоціація. Електролітична дисоціація - це процес розкладу електроліта на йони під впливом електричного поля. Електроліти - це речовини, які містять іоногенні групи, тобто групи, які можуть виділяти позитивні або негативні іони у розчин. При електролітичній дисоціації, наприклад, у розчині хлориду натрію (Na. Cl), молекули Na. Cl розбиваються на іони Na+ та Cl-. Цей процес відбувається за наявності електричного поля, яке змушує іони рухатися у протилежні напрямки. Електролітична дисоціація є важливим процесом у хімії, фізиці та біології.
Як впливає температура на провідність електролітів?Температура має значний вплив на провідність електролітів. Загалом, зі збільшенням температури, провідність електролітів збільшується. Це пов'язано з тим, що при підвищенні температури молекули розчинника та іони електроліту отримують більше енергії, що дозволяє їм рухатися швидше. Швидший рух іонів призводить до збільшення кількості зіткнень з іншими іонами та молекулами розчинника, що збільшує провідність електроліту. Однак, у деяких випадках, зі збільшенням температури, провідність електролітів може зменшуватися, особливо у високих концентраціях електроліту, через збільшення в'язкості розчину та зменшення рухливості іонів.
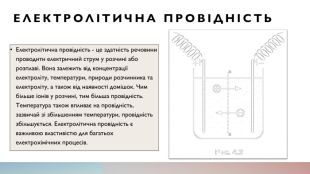
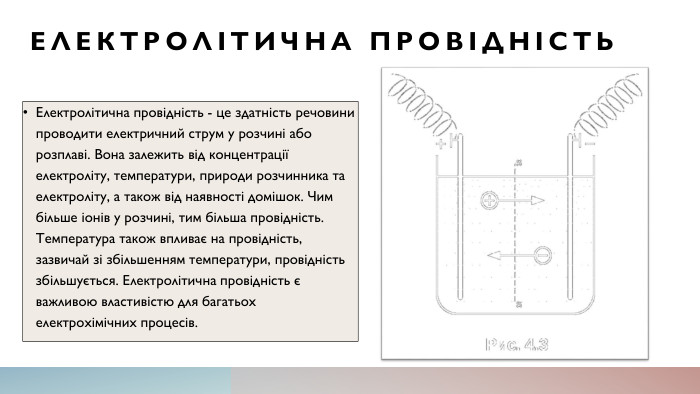
Електролітична провідність. Електролітична провідність - це здатність речовини проводити електричний струм у розчині або розплаві. Вона залежить від концентрації електроліту, температури, природи розчинника та електроліту, а також від наявності домішок. Чим більше іонів у розчині, тим більша провідність. Температура також впливає на провідність, зазвичай зі збільшенням температури, провідність збільшується. Електролітична провідність є важливою властивістю для багатьох електрохімічних процесів.
Як визначити електролітичну провідність?1. Підготуйте чистий і стабільний розчин електроліту, який ви хочете виміряти провідність.2. Підключіть провідник між джерелом струму (наприклад, батареєю) і провідним метром.3. Погрузьте електроди провідного метра в розчин.4. Запустіть джерело струму і заміряйте значення опору розчину за допомогою провідного метра.5. Використовуйте формулу провідності = 1 / опір, щоб визначити електролітичну провідність розчину.6. Повторіть вимірювання кілька разів, щоб переконатися в точності результатів.7. Для отримання більш точних результатів можна використовувати калібрований провідний метр, який має вбудований термометр для контролю температури розчину.
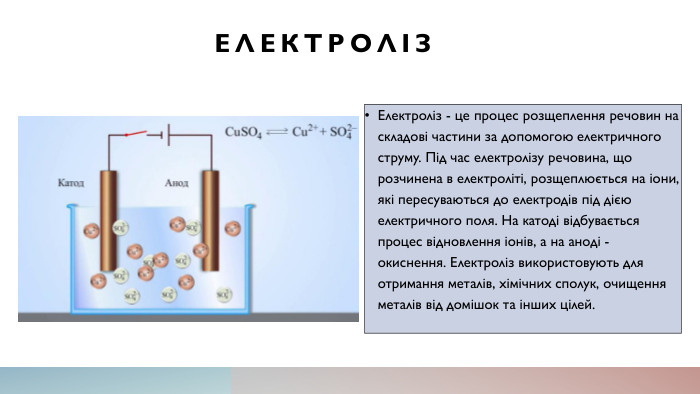
Електроліз. Електроліз - це процес розщеплення речовин на складові частини за допомогою електричного струму. Під час електролізу речовина, що розчинена в електроліті, розщеплюється на іони, які пересуваються до електродів під дією електричного поля. На катоді відбувається процес відновлення іонів, а на аноді - окиснення. Електроліз використовують для отримання металів, хімічних сполук, очищення металів від домішок та інших цілей.
Електролітичні клітини. Електролітична клітина - це пристрій, який використовується для проведення електролізу, процесу розщеплення речовин на іони під дією електричного струму. Клітина складається з двох електродів (аноду та катоду), які занурені у розчин електроліту. Електроди підключають до джерела струму, яке створює електричний потенціал між ними. Під час електролізу іони розчину переміщуються до відповідних електродів, де вони можуть реагувати і утворювати нові сполуки. Електролітичні клітини використовуються у багатьох галузях, включаючи хімічну промисловість, металургію та електрохімію.
Гальванічні елементи Гальванічний елемент - це пристрій, який перетворює хімічну енергію на електричну. Елемент складається з двох електродів (аноду та катоду), які занурені у розчин електроліту. Під час реакції на аноді відбувається окиснення, а на катоді - відновлення, що створює потенціал між електродами. Цей потенціал може бути використаний для забезпечення електричного струму. Гальванічні елементи використовуються у багатьох пристроях, включаючи батарейки та акумулятори. Будова сухого гальванічного елемента. Схема гальванічного елемента Даніеля-Якобі
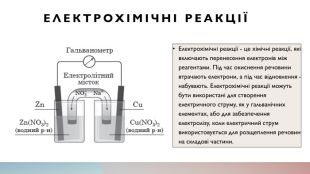
Електрохімічні реакції Електрохімічні реакції - це хімічні реакції, які включають перенесення електронів між реагентами. Під час окиснення речовини втрачають електрони, а під час відновлення - набувають. Електрохімічні реакції можуть бути використані для створення електричного струму, як у гальванічних елементах, або для забезпечення електролізу, коли електричний струм використовується для розщеплення речовин на складові частини.
Електролітичні процеси у промисловостіЕлектроліз використовують у промисловості для отримання металів, наприклад, алюмінію, міді, цинку та інших. Також електроліз використовують для отримання хімічних сполук, наприклад, хлору, натрію, кисню та інших. Крім того, електролітичний процес використовують для очищення металів від домішок, наприклад, заліза, свинцю та інших. Електролітичний процес є важливим етапом у виробництві багатьох продуктів, таких як електронні компоненти, лікарські засоби, фарби та інші.
Електролітична оксидування та редукція. Електролітичне оксидування та редукція - це процеси, при яких за допомогою електричного струму відбувається окиснення або зниження ступеня окиснення речовини. Під час електролітичного оксидування на електроді відбувається виділення електронів, що призводить до збільшення ступеня окиснення речовини. При електролітичній редукції на електроді відбувається поглинання електронів, що призводить до зниження ступеня окиснення речовини. Ці процеси використовуються для отримання різних хімічних сполук та металів. Карабіни, поверхневий шар яких отриманий методом анодного оксидування
Висновки... Електричний струм у електролітах може використовуватися для проведення процесів електролітичної оксидування та редукції, які дозволяють змінювати ступінь окиснення речовини та отримувати різні хімічні сполуки та метали. Ці процеси є важливими в хімічному виробництві та можуть бути застосовані для отримання різних продуктів з високою чистотою.


про публікацію авторської розробки
Додати розробку