Інтегрований урок з фізики та хімії у 8 класі "Застосування окисно – відновних реакцій у гальванічних елементах і у процесі електролізу"
Білоцерківська спеціалізована школа І-ІІІ ступенів №9
з поглибленим вивченням іноземних мов
Інтегрований урок
з фізики та хімії у 8 класі
Застосування окисно – відновних реакцій у гальванічних елементах і у процесі електролізу
Вдовиченко О.В., вчитель фізики, спеціаліст І категорії
Покотун Л.П., вчитель хімії,вчитель – методист,
спеціаліст вищої категорії
Мета уроку: Формувати ключові компетентності:
Вміння вчитися: організовувати своє робоче місце, виконувати логічні послідовні дії, поглибити знання про типи хімічних реакцій, окисно-відновних реакцій, поглибити знання про електроліз і закономірності, що характеризують процеси, що відбуваються на катоді та аноді в розчинах та розплавах солей, ознайомити із використанням електролізу в промисловості, формувати навички дослідницької і проектної роботи.
Комунікативні: уміння сприймати, розуміти і аналізувати матеріал, передавати інформацію, користуватися хімічною та фізичною термінологією, висловлювати і відстоювати свою думку та контролювати відповіді товаришів, вести діалог, поповнювати словниковий запас, удосконалювати вміння учнів розуміти артикуляцію вчителя, коригувати вимову
Здоров’язбережувальні: створювати позитивний настрій на уроці, виховувати культурно-гігієнічні навички, відповідальне ставлення до свого здоров’я.
Фінансова грамотність:розвивати лідерські ініціативи, показати економічну доцільність в добуванні металів за допомогою електролізу.
Екологічна грамотність: дізнатися про переробку гальванічних елементів з метою зменшення кількості токсичних речовин у природі
Формувати предметні компетентності: узагальнити знання учнів про окисно – відновні реакції; експериментально підтвердити існування електричного струму в електролітах, формувати знання про носії електричного струму в електролітах, пригадати закони електролізу, вчити визначати залежність між величинами, робити відповідні висновки; продовжити вчити користуватися таблицею для визначення електрохімічного еквівалента речовини, вчити розв’язувати задачі на обчислення маси виділеної на електроді речовини, виховувати почуття взаємодопомоги та відповідальності, самостійності та дисциплінованості, розвивати мислення, спостережливість та увагу, виховувати інтерес до природничо-наукових дисциплін, продовжувати знайомити учнів з біографіями видатних вчених.
Тип уроку: застосування знань, умінь та навичок
Обладнання: ванна з розчином мідного купоросу, тонка пластинка міді, джерело струму, електрод, провідники, портрет М. Фарадея, дидактичні матеріали, маршрутні листи, ноутбук, мультимедійний проектор, екран, таблиці «Періодична система хімічних елементів», «Електрохімічний ряд напруг металів», хімічний конструктор, презентація.
Міжпредметні компетентності: фізика, хімія, біологія, математика, інформатика.
Словник: катод, анод, електроліт, електроліз, електролітична дисоціація, катіон, аніон, електрохімічний еквівалент, окисно – відновні реакції, гальванопластика, гальваностегія, рафінування, електрометалургія
Хід уроку.
Те, що ми знаємо, — обмежене, а те, чого не знаємо, — безмежне. То ж пірнайте в цю безмежність і збагачуйтесь знаннями
П’єр Лаплас
І. Організаційний момент.
ІІ Психологічний настрій.
Ми віримо у себе і свої сили!
Ми віримо у свій успіх!
Ми віримо в успіх тих, хто з нами!
ІІІ. Мотивація навчальної діяльності.
Вчитель фізики. В Україні існує нагальна проблема утилізації різноманітних відходів, обсяги яких постійно збільшуються. На звалищах нагромаджено 27 млрд. т сміття. Щороку ця кількість зростає майже на один мільярд тонн. Сьогодні рівень перероблення відходів в Україні становить лише 5 %, а решта продовжує заповнювати полігони, отруюючи повітря, ґрунт, воду, зелені насадження. Серед відходів особливими певною мірою є відпрацьовані гальванічні елементи та акумулятори, які називають малими джерелами електричного струму (МДЕС). Вони містять різні токсичні кольорові метали та сполуки, вміст яких значно перевищує цю величину у природній сировині. Відтак МДЕС, з одного боку, висококонцентрована вторинна сировина, з іншого – екологічно небезпечний забруднювач довкілля завдяки наявності свинцю, кадмію, нікелю, ртуті тощо. На звалищах зовнішня частина МДЕС руйнується і шкідливі речовини потрапляють у ґрунтові води та річки. Так, наприклад, одна пальчикова батарейка робить непридатним для використання близько 20 м2 землі. Незважаючи на значну кількість наукових праць, спрямованих на вирішення проблеми утилізації МДЕС, багато питань залишаються невивченими. Тому перероблення відпрацьованих МДЕС є актуальним в економічному та екологічному аспектах.
Сьогодні ми з вами вирушаємо у квест – подорож, щоб більше дізнатися про гальванічні елементи, їх переробку та поглибити свої знання з хімії і фізики.
ІV. Актуалізація опорних знань.
Сьогоднішній урок доведе вам, що фізика і хімія – природничі науки, які вивчають однакові явища, використовують одні і ті ж терміни, тільки пояснюють їх з позицій своїх завдань. На уроці ви будете подорожувати отримувати бали за правильні відповіді, а в кінці уроку бали переведуться у оцінку. Розпочинаємо!
Отримуємо квитки на наш потяг! (Пазли) Відповідно того,що ви склали, займіть місця у потягу. Поїхали!
Станція І «Термінологічний перелісок»
Давайте пригадаємо терміни, якими ми будемо користуватися на уроці.
Інтерактивна вправа «Дешифровщик». Слова з хаотично розміщеними буквами потрібно скласти в правильні терміни і дати визначення цим термінам: ролілектез (електроліз), фінуравання (рафінування), літеролект (електроліт), техгальнівакано (гальванотехніка), мегіятаелерклутро (електрометалургія), соціадиція (дисоціація). Кожна правильна відповідь принесе вам 1 бал.
Вправа «Розмовна хвилина»
- Що таке електроліти? Електроліти – це речовини,водні розчини чи розплави яких проводять електричний струм.
- Чи усі речовини можуть бути електролітами? (Речовини полярні, з ковалентним полярним зв’язком (кислоти) тільки у розчині, і з йонним зв’язком (солі, основи), і у розчині, і у розплаві, в залежності від розчинності у воді)
- Що таке неелектроліти? Неелектроліти – це речовини,водні розчини чи розплави яких не проводять електричний струм, неполярі речовини.
- Хто придумав класифікувати речовини на електроліти та неелектроліти? Майкл Фарадей.
- Що таке електролітична дисоціація? Електролітична дисоціація- це розпад електроліту на йони внаслідок розчинення або розплавлення.
- Як атоми перетворюються в йони? (Внаслідов втрати чи приєднання електронів)
- Який заряд має катіон? Катіон має заряд «+».
- Який заряд має аніон? Аніон має заряд «-».
Вправа «Відеоопитування». За малюнком потрібно назвати термін, яким можна назвати дане зображення. - 1 бал. Зображення: Атом, молекула, ядро, орбіталь, гальванічний елемент, йонний зв’язок.
- Повідомлення теми та мети уроку.
Сьогодні на уроці ми з вами дізнаємося, про пристрій, який здатний перетворити хімічну енергію в електричну, поговоримо про його принцип роботи, види та основні характеристики; навчимося визначати масу речовини, яка виділяється на електроді під час електролізу. Запишемо тему уроку: «Застосування окисно – відновних реакцій у гальванічних елементах і у процесі електролізу»
- Формування диференційованих узагальнених умінь.
Станція ІІ «Історичний майдан»
Щоб ми з вами почули та побачили цікаві моменти з історії відкриття гальванічних елементів, нам потрібно виконати інтерактивну вправу «Закінчте речення». Працюємо в парах, ціна – по 1 балу за кожне запитання.
До джерела струму приєднаємо два електроди. Електрод, приєднаний до позитивного полюса джерела називається … анод -2 бали.
Електрод, приєднаний до негативного полюса називається.. катод -2 бали
Струм в електролітах обумовлений рухомими іонами, які на електродах нейтралізуються і перетворюються на атоми (або молекули). -2 бали
Аніони рухаються до анода, віддають зайві електрони і стають нейтральними – 2 бали
Катіони рухаються до катода, отримують електрони, яких не вистачає, стають нейтральними і осідають на катоді - 2 бали.
Йони можуть осідати на електрод або випадати в осад або виділятися в атмосферу.
Кожний йон має масу і переносить певний заряд. - 2 бали
Тобто, чим більше йонів осяде на електроді, тим більший перенесений заряд і тим більша буде маса електрода. - 2 бали
Евристична бесіда.
Вчитель фізики: Гальванічні елементи — це джерела струму з не відновлюваним запасом електричної енергії (наприклад, батарейки для калькуляторів, годинників, ліхтариків). До винаходу гальванічних елементів єдиним джерелом електрики були електростатичні машини (назва походить від грецького слова, що в перекладі означає «електрон; зі старовини була відома здатність шматків цього тіла заряджатися при терті і притягати легкі предмети). Що це? (бурштин) – 1 бал
Створенню постійних джерел струму сприяло відкриття, зроблене наприкінці XVІІІ століття італійським професором анатомії Луїджи Гальвані.
Гальвані препарував жабу, а неподалік стояла електростатична машина. Коли вістря скальпелю торкнулося стегнових нервів, то, як писав Гальвані, «негайно всі м’язи кінцівок почали так скорочуватися, що здавалися запалими в найсильніші тонічні судороги». Помічник Гальвані помітив, що в цей самий момент між полюсами машини проскочила іскра.
Однак у деяких дослідах жаб’ячі м’язи скорочувалися без усяких видимих причин: ні грози, ні електричної машини поблизу не було. Виявилося, що це відбувається в тих випадках, коли м’яз і нерв з’єднані металевим дротом, і особливо сильно — якщо цей дріт складений із двох різних металів; сильніше інших діяла пара залізо-срібло.
Станція ІІІ « Хімічне конструкторське бюро»
Вчитель хімії. Чому у природі відбуваються окисно – відновні реакції? (Атоми прагнуть завершити зовнішній енергетичний рівень і набути мінімальної енергії, завершеної структури).
Є реакції, які відбуваються із зміною ступеня окиснення, внаслідок віддачі або приєднання електронів.
Завдання.
Виставте правильно стрілки переходу електронів, атом – окисник, атом – відновник і відповідно процеси окиснення і відновлення.
![]() А0 + В0
А0 + В0 ![]()
![]()
![]()
n![]()
![]()
відновник окисник
окиснення відновлення
с.о зменшується с.о. збільшується
І VI
![]()
![]()
![]()
![]()
![]()
1![]() 2
2![]()
відновник окисник
окиснення відновлення
Наступна станція IV «Окисно – відновна електростанція»
Носіями електричного струму є йони. Порівняємо рух електронів у гальванічному елементі і процесах електролізу, а також визначимо, що є первинним: ОВР чи електричний стум у гальванічних елементах і при електролізі?
Розглянемо гальванічний елемент.
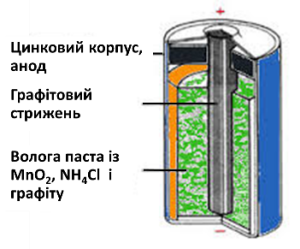
За малюнком, цинковий електрод є відновником, оскільки цинк є більш активним металом і розташований у електрохімічному ряді напруг ліворуч від Гідрогену. Сухий елемент (звичайна батарейка) наповнений пастою із суміші манган (IV оксиду), амоній хлориду, вугілля і води, в яку занурюють графітовий катод.
В гальванічному елементі первинним є окисно-відновні реакціі, а вторинним –електричний струм або причиною виникнення електричного струму в батарейках, акумуляторах є окисно-відновні реакціі.
Розглянемо електроліз.
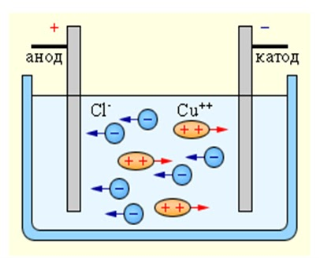
Електроліз – це сукупність окисно-відновних реакцій, що відбувається на катоді та аноді при проходженні постійного електричного струму через розплав або розчин електроліту.
Катод – негативно заряджений електрод, анод – позитивно заряджений. Катіони (позитивні йони) рухаються до катоду, а аніони (негативні йони) – до аноду.
На катоді відбувається процес відновлення. На аноді – окиснення.
При електролізі розплавів солей на катоді катіони відновлюються, на аноді аніони окислюються.
В процесі електролізу первинним є постійний електричний стум, який проходить крізь розчин або розплав електроліту. На катоді відбувається процес відновлення окисника, а на аноді – процес окиснення відновника.
Станція V «Бульвар дослідів»
Дослід 1.
Розглянемо процес електролізу на прикладі розчину мідного купоросу. Підведемо до розчину електричний струм, опустивши в нього металеві пластини – електроди й з’єднавши їх з полюсами джерела струму. У нашому експерименті мідна пластинка є анодом, а цинкова - катодом. Під дією електричного поля йони починають рухатися впорядковано. Процес електролізу дозволяє одержати чисту речовину з розплаву або розчину, наносити покриття на поверхню металів. Предмет, що його покривають, завжди є катодом. Для покриття сріблом, золотом чи іншими металами, анод завжди виготовляють з металу покриття, а електроліт являє собою розчин солі цього металу.
Дослід 2.
Зануримо у водний розчин купрум ІІ сульфату залізний цвях. Порівняємо активність металів за положенням у електрохімічному ряді напруг металів. Залізо, як більш активний метал, так як стоїть ліворуч від Гідрогену, витискує йони Cu2+, які відновлюються у вигляді червоної міді на залізному цвясі. За типом це реакція заміщення,яка також є окисно - відновною
Станція VІ Студія «Релакс»
Вправа «Порхання метеликів» (Звучить музика)
Уявіть собі прекрасний літній день. Ви лежите на зеленому лузі. Навколо все спокійно і тихо. Вам тепло і затишно, ви дихаєте легко і спокійно. Закрийте очі. Уявіть собі, що ви – легкі метелики з великими красивими крилами. Ваші ручки легкі-легкі – це крила метелика. І тіло ваше теж стало легке-легке, змахнули крильцями і полетіли. З кожним вдихом і видихом ви все вище і вище в повітрі. Легкий вітерець ніжно гладить ваші крильця .... Вам добре, приємно. Але ось прийшла пора повертатися в цю кімнату. Потягніться і на рахунок «три» відкрийте очі, посміхніться ласкавому вітерцю й один одному.
Вчитель фізики: Ми з вами наблизилися до станції VІІ – «Гай Фарадея».
Пригадаємо закон електролізу.
Перший закон Фарадея. Кількість речовини, яка виділяється на електроді, прямо пропорційна електричному заряду, що пройшов через електроліт або іншими словами: маса речовини, яка виділяється на електроді під час електролізу пропорційна силі струму І та часу t його проходження: m= kIt, де k – коефіцієнт пропорційності, який одержав назву електрохімічний еквівалент речовини. Оскільки q= It, то m= kq.
Зміст цього коефіцієнту можна з’ясувати з виразу: k= m / q.
Електрохімічний еквівалент чисельно дорівнює масі речовини в кг, що виділяється при проходженні 1 Кл електрики.
Другий закон Фарадея. Електрохімічні еквіваленти речовин прямо пропорційні відношенням їхніх атомних мас до валентності.
Закон електролізу встановив М. Фарадей у 1834р., тому його називають законом Фарадея. Що вам відомо про життя вченого?
Методичний коментар (Учні за бажанням отримали випереджувальне завдання і підготували презентацію про життя та відкриття Майкла Фарадея).
Учень1. Фарадей народився в Лондоні у 1791 році. Батько був коваль. Сім’я жила бідно, тому Майклові потрібно було працювати. З 12 років розносив газети, потім вчився переплітати книги. В школу не ходив, вчився сам, любив читати книги з хімії та електрики.
Учень2. Одного разу клієнт майстерні подарував йому білет на лекції в академії, які читав відомий вчений Деві. Лекції були дуже цікавими і Фарадей попросив вченого взяти його на роботу в лабораторію. Вчений був вражений знаннями хлопця і запросив на роботу. Це і вирішило його долю - Фарадей став вченим.
Учениця. В 33 роки став директором Королівської лабораторії. Встановив багато законів з електрики і магнетизму. Дружив з такими вченими як Ампер, Вольт. Був почесним членом 72 товариств. Його називали королем експерименту. Він виконав близько 30 тисяч експериментів. Англійська королева подарувала йому будинок, в якому Фарадей і помер у віці 76 років. Портрет вченого зображений на 20 франковій купюрі.
Вчитель фізики Ну, ось ви підійшли до наступної станції VІІІ «Галявина обчислень», ваше завдання тепер – розв’язати задачу.
Задача: 1. Скільки на алюмінієвому заводі витрачається електроенергії на одержання кожної тонни алюмінію? Електроліз проходить за напруги 850 В, а ККД установки становить 80%.
![]()
![]() Дано: СІ Розв’язання
Дано: СІ Розв’язання
m = 1т m = 1000 кг ![]() ; Акор = UIt; m = kIt;
; Акор = UIt; m = kIt; ![]()
U = 850В
![]() ƞ = 80% ƞ = 0, 8
ƞ = 80% ƞ = 0, 8 ![]() ;
; ![]()
А пов - ? З таблиці для
алюмінію ![]() k = 0,093·10-6
k = 0,093·10-6![]()
![]() =11425·109Дж
=11425·109Дж
Відповідь: 11425·109Дж
Станція ІХ Журналістське розслідування «Екологічна свідомость»
VI Рефлексія. «Рекламна пауза»
На самому початку уроку ми говорили про використання та утилізацію гальванічних елементів. Першочерговим завданням на шляху вирішення зазначеної вище проблеми є збір відпрацьованих МДЕС. Успішне виконання цього завдання залежить від інтелектуального рівня громадян України та їхньої екологічної освіти. Крім того, проблема утилізації відпрацьованих МДЕС в Україні стала на порядок денний лише кілька років тому, у той час як у країнах, що входять до складу ЄС, вже давно розроблена і запроваджена система збору цих відходів (Бельгія збирає 59 %, Швеція – 55 %, Австрія – 44 %, Німеччина – 39 %, Нідерланди – 32 %, Франція – 16 % від загальної їх кількості). Варто наголосити, що, всупереч очікуванням, громадяни України активно долучились до збирання відпрацьованих МДЕС, причому активність наростає. Я також знаю, що й ви долучилися до цього завдання. Чи готові ви поділитися своїми успіхами?
Наскільки активно громадяни України долучаються до сортування сміття та батарейок?
Де розташовані пункти прийому відпрацьованих гальванічних елементів у нашому місті?
Чи потребують контейнери з батарейками додаткових маркувань?
Чи є у нас в Україні заводи з переробки відпрацьованих батарейок?
Які хімічні сполуки та елементи містяться у елементах джерела живлення?
Які типи акумуляторів застосовуються у дитячих іграшках? А в автомобілях?
Чому потрібно пересипати відпрацьовані акумулятори діелектриком? На ці та інші запитання ви підготували відео відповідь. Переглянемо її.
VII Оцінювання. 23-24 - 12
21-22 – 11
19-20 б –10
17-18 – 9
15-16 -8
13-14 -7
11-12 – 6
9-10 -5
VIII Домашнє завдання:
Вчитель фізики: Ось і добігає кінця наша квест – подорож. Сподіваюся, що мандрівка для вас була цікава та пізнавальна. Впевнена, ви отримали масу задоволення від вміння використати свої знання.
Повторити §37-38 Вправа 38 завдання №2, 3 – письмово. Заповнити таблицю застосування електролізу.
Дякую за співпрацю.
Використані джерела:
- Фізика: підручник для 8 класу загальноосвітніх навчальних закладів/В. Г. Бар’яхтар, Ф.Я. Божинова, С.О. Довгий, О.О. Кірюхіна. - Х: Вид-во «Ранок», 2016. – 240 с.: іл., фот.
- Фізика: підручник для 9 класу загальноосвітніх навчальних закладів/М.І. Шут, М.Т. Мартинюк, Л.Ю. Благодаренко.-Ужгород.:Іва, 2009
- Хімія: підручник для 9 класу загальноосвітніх навчальних закладів/О.Г. Ярошенко.-К.:Освіта, 2009
- Хімія: підручник для 10 класу загальноосвітніх навчальних закладів/ П.П. Попель, - Київ, : Вид-во «Академія» 2010 – 210 с.
- Інтернет-песурси:
https://narodna-osvita.com.ua/3696--29-zakon-faradeya-dlya-elektrolzu.html
https://disted.edu.vn.ua/courses/learn/4334
http://dovidka.biz.ua/tsikavi-fakti-pro-alyuminiy
-
Дякую за цікаві ідеї))


про публікацію авторської розробки
Додати розробку
