Конспект уроку з фізики для учнів 8 класу на тему "Електричний струм у електролітах"
Матеріал поданий до інтегрованого уроку з участю вчителів фізики , хімії та біології.
Електричний струм у електролітах
Мета:
- навчальна: сформувати учнів знання про електричний струм в розчинах та розплавах електролітів; виявити основні особливості процесу електролізу; дослідити особливість відкладання речовини на електроді; показати залежність маси речовини сприймати інформацію та використовувати її ; вміння логічного мислення та аналізу процесів;
- розвивальна: розвивати вміння спостерігати, аналізувати фізичні, хімічні та біологічні явища, робити висновки;
- виховна: виховувати добросовісне ставлення до навчання; сприяти підсиленню інтересу до предметів природничого циклу; любові до природи.
Тип уроку: інтегрований урок фізики , хімії, біології, урок формування нових знань і навичок розв’язування задач, проведення фізичного експерименту.
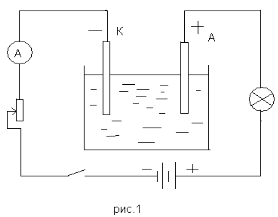
Обладнання: лабораторна установка для демонстрації явища електролізу( джерело живлення, амперметр, лампочка, реостат, вимикач, дистильована вода, мідний купорос, з’єднувальні провідники, електролітична ванна).
Демонстрації: явище електролізу.
Хід уроку
І. Організаційна частина.
ІІ. Перевірка домашнього завдання і актуалізація опорних знань.
Фронтальне опитування з теми «Електричний струм»
Метод «Гірлянда питань».
Учитель в ряд ,«гірляндою», вивішує на дошці картки із запитаннями на які потрібно дати відповідь.
Картка1. Що таке електричний струм?
Відповідь: електричним струмом - впорядкований (напрямлений) рух заряджених частинок .
Картка 2. Які умови існування електричного струму?
Відповідь: умовами існування електричного струму є наявність вільних носіїв заряду, наявність електричного поля, наявність напруги на кінцях провідника.
Картка 3. Які дії спричиняє струм?
Відповідь: дії електричного струму: теплова, хімічна, світлова, магнітна.
Картка 4. Які частинки є вільними носіями заряду в металах?
Відповідь: електричний струм у металевих провідниках створюється впорядкованим рухом вільних електронів.
Картка 5. Чи переноситься речовина при проходженні струму через метали?
Відповідь: При проходженні струму через метали , речовина не переноситься.
Картка 6. Як залежить опір металів від температури?
Відповідь: із збільшенням температури опір провідників збільшується.
Картка 7: Як проявляється хімічна дія струму?
Відповідь: хімічна дія струму проявляється в явищі електролізу.
ІІІ. Повідомлення теми і завдання уроку.
План вивчення теми
- Розчини електролітів. Електролітична дисоціація.
- Електроліз. Закони електролізу.
- Водно – сольовий баланс в організмі.
- Застосування електролізу.
ІV. Вивчення нового матеріалу.
1. Розчини електролітів. Електролітична дисоціація.
Розглядаючи тему «Дії електричного струму», ми зустрічалися із поняттям електролізу. Сьогодні на уроці ми більш детальніше розглянемо існування електричного струму в розчинах і розплавах електролітів . Які розчини відносять до електролітів і що є носіями електричного струму в електролітах з точки зору хімії.
Вчитель хімії.
Розглянемо механізм утворення йоного зв'язку на прикладі утворення молекули нагрій хлориду. Атоми Натрію і Хлору з електронними конфігураціями мають незавершені останні енергетичні рівні. Під час взаємодії атом Натрію віддає електрон і перетворюється на позитивно заряджений йон —катіон, атом Хлору приєднує електрон і перетворюється на негативно заряджений йон — аніон:
Na - е' = Na+. СІ + е = СІ-.
Внаслідок такого переходу електронна оболонка атома Натрію набуває конфігурації стійкої оболонки благородного газу Неону, а оболонка атома Хлору — оболонки Аргону. Йони Na+ і СІ- , які мають заряди протилежні за знаком, притягаються один до одного з утворенням молекули NaCl, що є стійкою сполукою з йоним зв'язком.
Йоний зв'язок утворюється внаслідок зміщення спільної електронної пари до більш електронегативного елемента і є граничним випадком ковалентного полярного зв'язку.
В основу механізму йоного зв'язку покладено електростатичну взаємодію, тому на відміну від ковалентного йона взаємодія не є напрямленою.
Йони можна уявити як заряджені кулі, силові лінії електричного поля яких сферично симетричні, тому кожен йон може притягувати до себе йони протилежного знака в будь-якому напрямку.
Система двох зарядів однакових за величиною, але протилежних за знаком, створює в довколишньому просторі електричне поле, тобто взаємодія двох йонів не приводить до повної взаємної компенсації їхніх силових полів. Кожен з йонів зберігає здатність притягувати йони протилежного знака, отже, йоний зв'язок характеризується ненасичуваністю.
Сполуки з йоним типом зв'язку у вигляді молекул не існують ні у твердому стані, ні в розчині.
Одже:
- Електроліти під час розчинення у воді розпадаються (дисоціюють) на позитивно й негативно заряджені йони. Розпад на йони здійснюється під дією диполів води.
- Йони в розчині перебувають у гідратованому стані, тобто вони оточені диполями води.
-
Під дією електричного струму позитивно заряджені йони (катіони) рухаються
до катода, негативно заряджені (аніони) — до анода. Завдяки руху йонів розчини електролітів проводять електричний струм. -
У розчинах на йони розпадаються речовини з йоним і ковалентним полярним
зв'язком. - Властивості йонів відмінні від властивостей атомів, що утворили їх.
- Йони можуть складатися з одного атома (наприклад Na+, СІ- ) або з декількох атомів .
 Опираючись на матеріал викладений вчителем хімії, вчитель фізики робить висновоки, які учні записують в зошит у вигляді тез. (Конспект «К»)
Опираючись на матеріал викладений вчителем хімії, вчитель фізики робить висновоки, які учні записують в зошит у вигляді тез. (Конспект «К»)
«К» Розчеплення електроліту на йони у водному розчині або розплаві називається електролітична дисоціація.
Електроліти - це розчини, що здатні проводити електричний струм.
Носіями електричного струму в розчинах електролітів є позитивні і негативні йони.
2. Електроліз. Закони електролізу.
Вчитель фізики. Використовуючи електролітичну ванну з розчином мідного купоросу (СuSO4), складемо електричне коло за рис.1 і переконаємося у проходженні стуму через цей розчин. (При замиканні ключа повинна загорітися лампочка).
Якщо струм протікає крізь розчин мідного купоросу, то з часом на катоді утвориться тонкий шар міді.
Отже, у розчині під дією електричного поля до катода переміщаються позитивно заряджені йони Сu2+ , які при контакті з катодом приєднують до себе недостатні електрони і нейтралізуються. Нейтральні атоми, що утворилися, осідають на електроді.
«К» Процес виділення речовини на електродах під час протікання електричного струму крізь розчин або розплав електролітів називають електролізом.
Струм в електролітах супроводжується перенесенням речовини.
Опір електролітів з підвищенням їх температури зменшується.
На наступному уроці у нас буде можливість визначити кількість міді, що відклалась на катоді , виконавши лабораторну роботу на тему «Вивчення явища електролізу. Визначення маси речовини, що відклалась на катоді при проходженні струму через електроліт».
Кількість міді, що осіла на катоді, а в тому числі і інших речовин , досліджував англійський вчений Майкл Фарадей. На основі своїх досліджень були сформульовані закони, які дістали назву закони Фарадея або закони електролізу.
«К» І закон Фарадея.
Маса речовини, яка виділяється на катоді під час електролізу, прямо пропорційна електричному заряду. Що проходить через електроліт, або добутку сили струму і часу проходження струму через електроліт.
m = kq= kIt
де m – маса речовини, виділеної на електроді;
k – коефіцієнт пропорційності, який називається електрохімічний еквівалент даної речовини.
q – заряд, що походить через електроліт.
I – сила струму в колі.
t – час проходження електричного струму через електроліт.
ІІ закон Фарадея характеризує властивості електрохімічного еквіваленту.
Електрохімічний еквівалент речовини прямо пропорційний масі її молів і обернено пропорційний її валентності.
k=![]() =
= ![]()
М – молярна маса речовини,
Na –стала Авогадро , Na = 6,023· 1023моль-1
е- заряд електрона , е= 1,6·10-19Кл
F – стала Фарадея, F = е · Na = 9, 65·104Кл/моль
Електрохімічний еквівалент має табличне значення. Розглянемо таблицю 10 збірника А.П.Римкевича. За таблицею з’ясуємо одиниці вимірювання електрохімічного еквівалента та його значення для різних речовин.
До твердих тіл з йоною структурою можна віднести звичайну кухонну сіль (NaCl). Вільних електронів в йоних кристалах немає, а ті, що віддають атоми металу (Na+), утворюють негативні йони галогену (СІ-), внаслідок чого виникає хімічний зв'язок. Отже, вільних носіїв електрики в йоних кристалах немає, тому при невисоких температурах вони є добрими ізоляторами. У посудині з кристалами сухої кухонної солі ніякого струму не виникає. Якщо ж надати йонам рухливості, перевівши йонні кристали в рідкий стан шляхом їх нагрівання і розплавлення, то речовина стане провідником струму. Відомо, що розплави солей та інших сполук проводять струм.
3. Водно – сольовий баланс в організмі.
Надамо слово вчителю біології.
Велику роль у підтримці водо – сольового балансу в організмі відіграють нирки.
Важливим показником гомеостазу є концентрація в крові іонів, зокрема Натрію та Хлору Як підтримується вона сталою, адже ми іноді вживаємо в їжу дуже солоні продукти?
Цей процес регулюється нервовою системою і гуморальною. Підвищення концентрації солі в крові реєструють нейрони, більшість яких розташована в головному мозку (у гіпоталамусі). У відповідь на їх подразнення гіпоталамус виробляє антидіуретичний гормон (вазопресин), який діє на нефрон, підсилюючи реабсорбцію води. Концентрація іонів Натрію і Хлору в крові зменшується, і гомеостаз відновлюється. Відповідно, у сечі концентрація солі збільшується, організм позбавляється від її надлишків.
Якщо ж в організмі є надлишок води, гіпоталамус зменшує вироблення вазопресину, реабсорбція послаблюється — води з вторинної сечі в кров повертається менше. Отже, більша її кількість виводиться з організму.
У нирках, крім зовнішніх регуляторів, є власний механізм регуляції об'єму крові, що надходить до неї, а отже, й очищується за певний час. Певні клітини нирки синтезують гормон ренін, який регулює кров'яний тиск у системі кровообігу нирок. Якщо кількість цього гормону не відповідає нормі. виникає так звана ниркова гіпертонія.
А тепер розглянемо, чи може сіль бути шкідливою для організму людини?
Уявімо, що нам потрібно закип'ятити 3-літрову банку дистильованої води за допомогою кип'ятильника з лез. Для того, щоб зробити це зі звичайною водою з-під крана, у нас піде близько трьох хвилин, тому що будь-яка вода в природному вигляді завжди містить у собі певну кількість солей. Але дистильовану воду не вийде закип'ятити навіть за три дні — у ній солей немає взагалі. А тепер уявімо, що ми кинули в цю банку дрібку солі. Вода тут же почне закипати! Значить, додавши у воду зовсім трохи солі, ми фундаментально змінили найважливішу її якість — електропровідність. Ми діелектрик перетворили на електроліт! Крім того, збільшуючи кількість солі у воді, ми будемо збільшувати її електропровідність.
Тепер згадаймо ось що. Навіть для медицини не секрет, що нервові імпульси в людському тілі мають електричну природу. І тут виникає природне запитання — що буде, якщо в організм людини ввести сіль? Відповідь очевидна — електропровідність організму збільшиться. Це загрожує щонайменше розладом нервової діяльності, яка тепер повинна буде протікати в неприродних для неї умовах. До чого це може призвести - ні до чого хорошого. При постійному вживанні солі нервова система буде просто зношуватися. Сіль буде прискорювати провідність імпульсів, що призведе до передчасного старіння.
Можуть заперечити, що сіль — необхідний елемент в організмі людини і він присутній там завжди. Без сумніву, це так. Адже вона допомагає проводити нервові електричні імпульси, які керують усією роботою організму. Але якою має бути її кількість? Хіба не достатньо тієї мінімальної кількості, що міститься у фруктах і овочах? Нам відомо, що людина все життя може не спробувати і дрібки солі і все одно буде нормально жити, точніше, набагато краще. Тому навіщо додавати до свого раціону те, що збільшує електропровідність внутрішнього середовища, заважаючи нормальній роботі нервової системи, від якої у свою чергу залежить нормальна робота всіх інших систем і органів? Адже в якості джерела солі все, що понад сирої рослинної їжі, — зайве, а значить, шкідливе.
Ще можна заперечити, що організм намагається підтримувати постійний рівень водно-сольового балансу в крові, що ми щойно розглянули. Так, це справді дуже важливо для організму. Але задайтеся запитанням, по-перше, яких зусиль вартує це організму, по-друге, де все-таки зберігається сіль, яка не потрапила в кров? Хіба не в тому ж організмі? І хіба в тих його частинах нема нервової тканини?
Концепція шкоди солі підтвердилася і при вживанні глутамату натрію — відома харчова добавка «підсилювач смаку». Ось як описується дія цієї добавки на організм: «Він (глутамат) викликає посилення чутливості всіх рецепторів організму, тому що впливає на нейромедіатори, збільшуючи провідність нервових каналів і тим самим збільшуючи силу імпульсу». Хіба не те саме робить сіль як підсилювач смаку? Її смак і здатність перетворювати будь-які помиї в прийнятну їжу ґрунтуються на тому самому ефекті підвищення електропровідності. Тут ідеться про «всі рецептори організму», а не тільки про ті, що на язиці. От і уявіть масштаби впливу цих речовин на роботу організму. Глутамат, до речі, справді дуже схожий на сіль за своєю дією — він може перетворити навіть гамбургер на бажану їжу. Ось чому смак продуктів із громадських харчевень неможливо відтворити в домашній кухні, навіть якщо в точності повторювати весь рецепт і пропорції інгредієнтів — вдома просто немає глутамату натрію чи інших підсилювачів смаку (але в приправах вони вже є).
У цій властивості солі та глутамату полягає ще один мінус — небезпека переїдання через обман рецепторів смаку.
Не слід також забувати і про те, що сіль, яка продається зараз — це не завжди тільки сіль. Наприклад, усім відома «Екстра» містить сполуки алюмінію (розпушувачі, що перешкоджають злежуванню) — елемента, не властивого природі людини. Також відомі йодована, фторована, очищена або будь-яким іншим методом «вдосконалена» сіль.
- Застосування електролізу.
Вчитель фізики. Вислухавши розповідь вчителя біології , ви можете задатися запитанням, якщо електроліти існують і в нашому організмі і створюють мікроструми, то чи не можна їх застосовувати у техніці?
Так. Електричний струм в електролітах, а в тому числі і електроліз, набули широкого використання в різних галузях.
«К» А саме, застосовується:
- При очищенні металів ( рафінування). Зокрема при добуванні чистої міді;
- Гальванопластика. Для отримання металевих копій предметів.
- Гальваностегія. Нанесення тонкого шару металу на предмети чи деталі, що може захищати метал від корозії; позолочення, посріблення. Нікелювання, хромування.
- Електрометалургія. Отримання чистих металів за рахунок електролізу руд.
- Електролітичне полірування.
- Очищення давніх металевих предметів.
V. Закріплення вивченого матеріалу
Задача1. Визначте силу струму, при якій відбувається електроліз у розчині мідного купоросу, якщо за 20хв на катоді виділилося 4г міді. (Відповідь: 10А)
Задача 2. Через електролітичну ванну з розчином мідного купоросу пройшов заряд 40Кл. Визначте масу міді, яка виділилась на електродах. (Відповідь: 13,2мг)
VІ. Підсумок уроку.
«Найголовніша формула успіху – знання і мислення», вважав Теодор Рузвельт.
Скористаємося методом «Ланцюжка» (доповнити речення)
- Електроліти – це розчини............................. ( що проводять електричний струм)
- Носіями електричного заряду в електролітах є ………( позитивні і негативні йони)
- Електролітична дисоціація – це ……………( розпад електроліту на йони у водному розчині).
- Електроліз – це………………………( процес виділення речовини на електродах під час проходження електричного струму через розчин)
- При проходженні струму через електроліт відбувається……………( перенесення речовини).
- Опір електролітів із підвищенням температури ………….(зменшується.)
- Сформулювати закони електролізу.
VІІ. Домашнє завдання.
§23 Підручник авт.В.Сиротюк. Запитання ст.91.
Підготувати повідомлення про використання електролізу.
Задача. Під час визначення електрохімічного еквівалента міді одержали такі дані: час пропускання струму t=25хв; сила струму I=0,6А; маса катода до досліду m1= 52,41 г, а після досліду m2=52,70г. яке значення електрохімічного еквівалента одержали на основі цього досліду?
Література
1.Сиротюк В.Д. Фізика підруч. для 8-го кл. загальноосвт. навч. зкл./ В.ДСиротюк. – Київ: Генеза, 2016. – 192с.
2. Вердіна С.В., Панченко А.Г. Секрети педагогічної майстерності. Уроки для вчителя. - Х.: Вид. група «Основа», 2008.-111с.
3.Ворожейкіна О.М. Сто цікавих ідей для проведення уроку. – Х.: Вид. група «Основа», 2011.- 287с.
4.Гін А.О. Прийоми педагогічної техніки: Вільний вибір. Відкритість. Діяльність. Зворотний зв'язок. Ідеальність: посібник для вчителів.- Луганськ, 2004.- 84с.
5.Степанюк А.В., Гадюк Т.В. Інтеграція природничих дисциплін у школі // Педагогіка і психологія. – 1996. – №1. – С.18-24.


про публікацію авторської розробки
Додати розробку
