Матеріал до уроку з біології 11 класу з тестами до теми «Як найти фермент в тканинах та визначити його властивості»
1
«Як найти фермент в тканинах та визначити його властивості»
ЗМІСТ
1. Властивості ферментів як біологічних каталізаторів
2. Способи вираження активності ферментів
3. Методи визначення активності ферментів у біооб’єктах
4. Методи виділення та очистки ферментів
5. Стратегії протеомного аналізу
ВСТУП
Всі біологічні каталізатори є речовинами білкової природи і носять назву ферментів або ензимів.
Ферменти не являються компонентами реакцій, а лише прискорюють досягнення рівноваги збільшуючи швидкість як прямого, так і зворотного перетворення. Прискорення реакції відбувається за рахунок зниження енергії активації того енергетичного бар'єру, який відокремлює один стан системи (початкову хімічну сполуку) від іншого (продукт реакції).
Ферменти прискорюють самі різні реакції в організмі.
Ферменти є важливими компонентами тварин, рослин і мікроорганізмів, оскільки вони каталізують і координують складні реакції клітинного метаболізму.
Аж до 1970-х років велика частина комерційного застосування ферментів була пов'язана з тваринними і рослинними джерелами. У той час об'ємні ферменти зазвичай використовувалися тільки в харчовій промисловості, і ферменти тварин і рослин були кращими, тому що вважалося, що вони вільні від проблем токсичності і забруднення, пов'язаних з ферментами мікробного походження. Однак у міру зростання попиту і розвитку технологій ферментації була визнана конкурентоспроможна вартість мікробних ферментів, і вони стали більш широко використовуватися.
У порівнянні з ферментами з рослинних і тваринних джерел мікробні ферменти мають економічні, технічні і етичні переваги
Мета роботи – визначити основні параметри, що досліджуються та вивчаються у ферментів; дати загальну характеристику особливостям методів виділення та дослідження ферментів у тканинах.
ОСНОВНА ЧАСТИНА
1. Властивості ферментів як біологічних каталізаторів
Ферменти (ензими) – біологічні каталізатори білкової природи, які синтезуються в клітинах живих організмів і забезпечують необхідні швидкість і координацію біохімічних реакцій, що становлять обмін речовин (метаболізм).
Властивості ферментів:
- ферменти значно підвищують швидкість перебігу біохімічних реакцій, але не входять до складу кінцевих продуктів реакції;
- ферменти забезпечують перебіг лише тих біохімічних реакцій, які можливі згідно з законами термодинаміки;
- ферменти прискорюють швидкість як прямої, так і зворотної реакції перетворення субстрату, не змінюючи константи рівноваги (Кр) реакції та зменшуючи термін часу до досягнення стану рівноваги (або стаціонарного стану у відкритій метаболічній системі);
- протягом реакції фермент певним чином взаємодіє із субстратом, що перетворюється, але до складу кінцевих продуктів реакції не входить. Під час перебігу біохімічної реакції, що каталізується, відбувається циклічний процес, в ході якого фермент та субстрат підлягають ступінчастому перетворенню з утворенням продукту реакції та регенерацією ферменту;
- ферменти є високоспецифічними каталізаторами, тобто діють, як правило, на структурно близькі субстрати, що мають певний хімічний зв’язок, структурно подібні радикали або функціональні групи. Проявом високої специфічності ферментів є їх стереоспецифічність, тобто здатність перетворювати тільки певні стереоізомери, наприклад L- або L-амінокислоти, D- або L-моносахариди;
- відповідно до білкової природи, каталітична активність ферментів дуже чутлива до змін фізико-хімічних властивостей середовища (рН, температури), які можуть впливати на структурну організацію молекул ферментів, спричиняючи в певних умовах їх денатурацію;
- активність ферментів може суттєво змінюватися під впливом певних хімічних сполук, що збільшують (активатори) або зменшують (інгібітори) швидкість реакції, яка каталізується.
2. Способи вираження активності ферментів
У біологічних об'єктах ферменти знаходяться в дуже мізерних концентраціях, тому для оцінки ферментативних процесів визначають не зміст ферментів, що пов'язано з великими труднотами, а швидкість каталізованої реакції. Швидкість ферментативної реакції залежить як від активності, так і від кількості ферменту. Дослідження проводять з умовах оптимальної температури (25 С). рН середовища і повного насичення ферменту субстратом.
Швидкість ферментативної реакції оцінюють за кількістю розщепленого субстрату або за кількістю утвореного продукту реакції. За міжнародну одиницю активності ферменту приймається та його кількість, що перетворює один мікромоль субстрату (мкмоль) за одну хвилину в стандартних умовах (МО=мкмоль/хв).
Новою міжнародною одиницею активності ферменту є катал (кат.). Він відповідає кількості ферменту, що перетворює 1 моль субстрату в продукт за 1 с (Кат = моль/с).
Відношення міжнародної одиниці (МО) до каталу виражається таким чином: 1 кат = 1 моль • с–1 = 60 моль • хв.–1 = 60 • 106 мкмоль • хв.–1 = 6 • 107 МО; або МО= 1 мкмоль • хв.–1 = 1/60 мкмоль • с–1 = 1/60 мккат= 16,67 нкат.
Активність ферментів виражають ще через питому і молекулярну активність. Питома активність ферменту виражається числом одиниць ферментативної активності, що припадає на 1 мг білка. Чим виша питома активність, тим чистіший виділений фермент. Кількість молекул субстрату, що перетворюється однією молекулою ферменту за хвилину, називають сукупністю обертів, або молекулярною активністю ферменту. Наприклад, одна молекула каталази еритроцитів здатна розщепити за 1 хв 5 • 106 молекул перекису водню.
3. Методи визначення активності ферментів у біооб’єктах
Здебільшого кількість фермента не можна виміряти в одиницях маси, тобто в міліграмах або в моль, про неї опосередковано свідчить його активність, тобто дія фермента. Іншими словами, присутність і кількість фермента виявляють за специфічністю та швидкістю реакції, яку він каталізує. Активність фермента можна визначити опосередковано: за визначенням кількості продукту, який утворився під дією ферменту або за кількістю витраченого субстрату за одиницю часу при оптимальних умовах ферментативної реакції. Наприклад, активність α-амілази, яка каталізує гідролітичне розщеплення крохмалю з утворенням у кінцевому результаті мальтози, розраховують на основі кількості негідролізованого крохмалю або за кількістю утвореної мальтози.
Найчастіше активність ферментів визначають у сироватці, плазмі або клітинах крові та в сечі колориметричними, спектрофотометричними, флюориметричними, манометричними, кондуктометричними, віскозиметричними методами. У клініко-діагностичних лабораторіях для визначення активності ферментів переважно застосовують колориметричні та спектрофотометричні методи.
В основі колориметричних методів лежить вимірювання за допомогою фотоелектроколориметра інтенсивності забарвлення речовини, яка утворюється під час взаємодії субстрату або продукту ферментативної реакції зі специфічними реактивами, які додаються у пробу після припинення реакції. Наприклад, продуктом дії ЛДГ в умовах прямої реакції є піруват, який з 2,4-динітрофенілгідразином утворює у лужному середовищі забарвлений гідразон. Інтенсивність забарвлення пропорційна кількості пірувату, а, значить, і активності фермента.
Спектрофотометричні методи реєструють поглинання світла в певних ділянках спектра коферментами, субстратами або продуктами реакції. Ці методи широко застосовують для визначення активності оксидоредуктаз, зокрема НАД+ - та НАДФ+ -залежних дегідрогеназ.
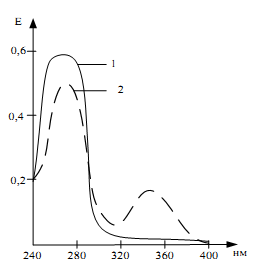
Рисунок 1 – Абсорбційні спектральні криві для окиснених НАД+ (або НАДФ+ ) (1) та відновлених НАДН (або НАДФН) (2) нікотинамідних коферментів
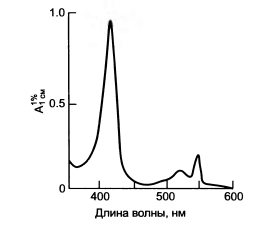
Рисунок 2 – Спектр поглинення відновленого цитохрому с
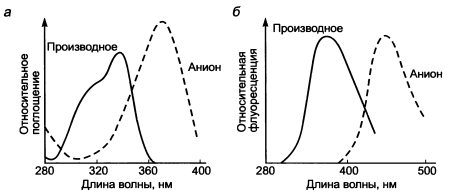
Рисунок 3 – Спектри поглинання (а) і флуоресценції (б) аніону метілумбелліферона і похідних 4-метілумбелліферона при рН 10 (вивчення гідролаз).
Перехід НАД+ або НАДФ+ з окисненої форми у відновлену супроводжується зміною поглинання в ультрафіолетовій ділянці спектра. В окисненій формі кофермент дає одну вузьку смугу поглинання при λ=260 нм, яка обумовлена наявністю аденіну в його молекулі. У разі відновлення кофермента поглинання світла в цій зоні дещо знижується, але з’являється інша широка смуга поглинання при λ=340 нм.
Поява цієї смуги зумовлена зникненням одного подвійного зв’язку у піридиновому кільці аденіну під час його відновлення. Визначення активності ферментів за різницею спектрів поглинання окисненої та відновленої форм НАД+ (або НАДФ+) та НАДН (або НАДФН) називають тестом Варбурга (рис.1).
4. Методи виділення та очистки ферментів
Уся інформація про метаболічні процеси, проміжні сполуки, які утворюються на різних етапах метаболічних шляхів та про механізми регуляції каталізаторів отримується, здебільшого, з використанням очищених препаратів ферментів. Вони необхідні також для аналізу кінетики, характеристики активних центрів, кофакторів, структури та механізмів дії ферментів.
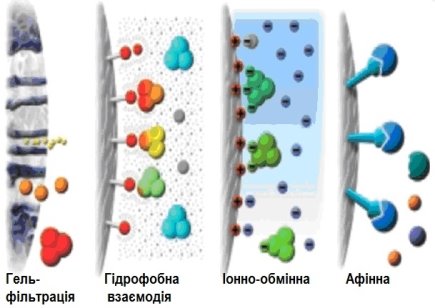
Рисунок 4 – Схема порівняння методів очищення
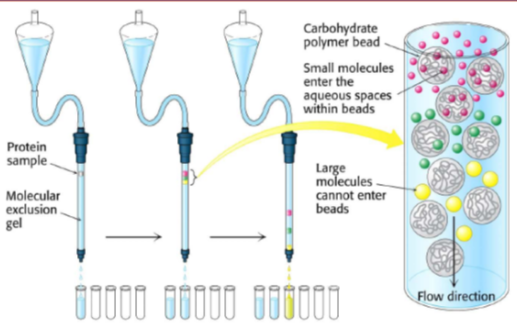
Рисунок 5 – Гель-хроматографія
Процес очищення ферментів полягає у виділенні їх з клітинного екстракту, який містить велику кількість інших компонентів. Невеликі молекули видаляють методом діалізу або гель-фільтації; нуклеїнові кислоти – осадженням шляхом додавання антибіотика тощо. Але основна проблема – відділити потрібний фермент від сотень хімічно та фізично подібних білкових молекул. Для цього широко застосовують осадження різними концентраціями солей (найчастіше сульфату амонію чи сульфату натрію) та органічними розчинниками (ацетоном, етанолом); диференційну денатурацію шляхом нагрівання чи зміни рН; диференційне центрифугування; гельфільтрацію та електрофорез.
Для швидкого очищення білків успішно використовують вибіркову адсорбцію та елюцію білків з целюлозного аніонообмінника діетиламіноетилцелюлози та катіонообмінника карбоксиметилцелюлози, а також розділення білків за розміром на молекулярних ситах, наприклад, сефадексі.
Проте ефективнішим є метод афінної хроматографії, який дозволяє вибірково виділяти зі складної суміші білків один конкретний білок або невелику їх кількість.
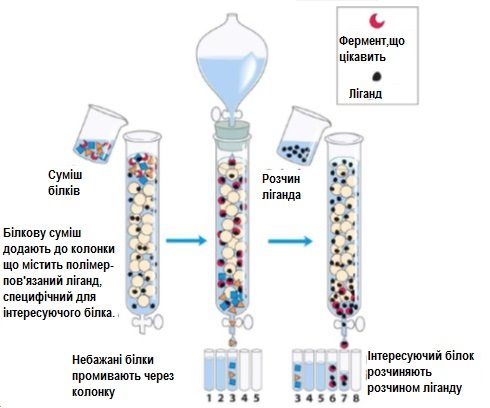
Рисунок 6 – Афінна хроматографія
Цей метод базується на використанні іммобілізованого ліганда, який специфічно взаємодіє з тим білком, який необхідно отримати в чистому вигляді. Зі всіх білків, які присутні в суміші, з іммобілізованим лігандом зв’язуються лише ті білки, які можуть вступати з ним у потужну взаємодію. Потім потрібний фермент «знімають» з іммобілізованого ліганда або концентрованими сольовими розчинами, або розчином, який містить розчинну форму ліганда. Оскільки ферменти проявляють високу специфічність до своїх субстратів і коферментів, тому в якості лігандів найчастіше використовують похідні субстратів і коферментів, ковалентно зв’язаних з носієм, наприклад, сефадексом. Прикладом успішного використання афінної хроматографії може служити очищення великої кількості дегідрогеназ.
З афінною хроматографією схожа хроматографія з використанням у якості лігандів барвників (блакитна, зелена або червона сефароза), а також хроматографія на гідрофобних лігандах із використанням у якості носія феніл- або октилсефарози.
Локалізацію фермента в тканині чи клітині часто вдається ідентифікувати in situ гістохімічними методами (гістоензимологія). Розподіл ферментів у субклітинних органелах вивчають після попереднього фракціонування клітинних гомогенатів шляхом високошвидкісного центрифугування, визначаючи вміст ферментів у кожній фракції (табл.).
Таблиця – Локалізація деяких ферментів у клітині
|
Цитозоль |
Мітохондрії |
Лізосоми |
|
Ферменти гліколізу Ферменти пентозофосфатного циклу Ферменти активації амінокислот Мультиферментний комплекс синтезу жирних кислот Ферменти катаболізму пуринових і ніримідинових основ Пептидази А м і нотрансферази Малатдегідрогеназа Ізоцитратдегідрогеназа (НАД-залежна) Глікоген фосфорилаза Глікогенсинтетаза |
Піруватдегідрогеназний комплекс Цитратсинтетаза Ізоцитратдегідрогеназа (НАД-залежна) Малатдегідрогеназа та інші ферменти циклу Кребса Ацил-КоА-дегідрогеназа та інші ферменти окиснення жирних кислот Ферменти дихального ланцюга та окиснювального фосфорилування |
Кисла фосфатаза [І-Глюкуронідаза а-Глюкози даза (І-Глюкозидаза Катепсини Кисла рибонуклеаза а-Галактозидаза Лізоцим Гіалуронідаза Арилсульфатаза Колагеназа |
|
Мікросомна фракція |
Плазматична мембрана |
Ядро |
|
НАДН- і НАДФН- цитохром С редуктази, цитохром Р450- і цитохром Ь5-оке ид ази, глюкозо-6-фосфатази, естерази, нуклеозиддифосфатази, глюкуронілтрансферази, фосфогліцерид- і тріацилгліцеридсиитетази, р-глюкуронідази Гл юкозо-6-фосфатаза Рибоеомиі ферменти синтезу білка Ферменти, які беруть участь у реакціях гідроксилування Ферменти синтезу фосфолінідів, тригліцеридів, а також деякі ферменти синтезу холестерину |
Аденілагциклаза Лужна фосфатаза Ыа+-К+-залежна АТФаза |
Ферменти, які беруть участь у процесі реплікації ДНК РНК-полімераза НАД-синтетаза |
|
Ендоплазматичний ретикулум |
Комплекс Гольджі |
|
|
Гл кжозо-6-фосфатаза |
Галактозилтрансфераза |
|
Для цього спочатку руйнують клітинну структуру за допомогою відповідного дезінтегратора, утворена гомогенізована маса підлягає диференційному центрифугуванню при температурі 0 – 4 0о С. Центрифугування різними швидкостями гомогенатів різних тканин забезпечує седиментацію (осідання) субклітинних структур, що дозволяє згодом дослідити їх склад.
Якщо говорити про вузькоспеціалізовані клітини, то ферментів, які забезпечують їх функціонування в цих клітинах знаходиться більше порівняно з іншими. Наприклад, у клітинах міокарда підвищена кількість креатинкінази та аспартатамінотрансферази, у гепатоцитах – аланінамінотрансферази, в остеобластах – лужної фосфатази тощо.
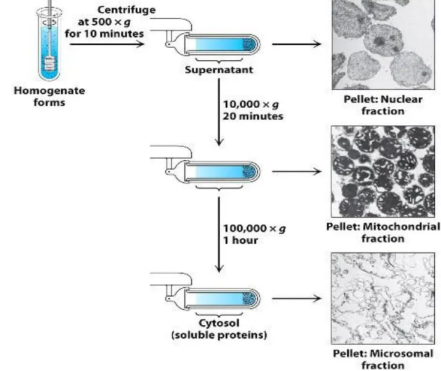
Рисунок 7 – Етапність центрифугування гомогенату: клітини руйнуються в гомогенізаторі, і отримана суміш (гомогенат) центрифугується методом «крок-за-кроком» – збільшення відцентрової сили. Більш щільний матеріал буде утворювати гранули при меншій відцентровій силі, ніж менш щільний матеріал. Ізольовані фракції можна використовувати для подальшої очистки.
5. Стратегії протеомного аналізу
Методологія протеомного аналізу включає ідентифікацію та кількісне визначення білків в специфічному організмі або різних типах клітин. Оскільки протеом клітини містить від тисяч до десятків тисяч різних типів білків з діапазоном експресії величиною в п'ять порядків, це - складна проблема. Існуюча технологія включає (Рис.8) пошук білкових компонентів, поділ цієї надзвичайно складної суміші, ферментативне розщеплення, мас-спектрометричний аналіз і, нарешті, знаходження відповідності отриманих структурних даних з базами даних по відомим білків або очікуваним продуктам експресії генома. На практиці ця технологія включає в якості початкового кроку одно - або двовимірний електрофорез (2-DЕ), методику, вперше введену для розділення білків в 1970 р, яка, незважаючи на її багато недоліків, поки ще не замінна.
Мас-спектрометрія застосовується для ідентифікації розділених білків. В даний час 2-DЕ і мас-спектрометрії є інтегровану або пов'язану технологію для поділу, детектування і ідентифікації декількох тисяч білків в автоматичному режимі.
Стандартна процедура при переході від поділу білків до мас-спектрометрії включає вирізання плям цікавлять білків з гелю 2-DЕ з подальшим індивідуальним протеолізом (зазвичай за допомогою трипсину). Отримана пептидна суміш далі аналізується на мас-спектрометрі з джерелом МАLDI, часто найбільш підходящому для початкового мас-спектрометричного дослідження. Щодо простий в управлінні і високоавтоматизований, цей вид мас-спектрометрії не чутливий до наявності детергентів, солей і буферів і може аналізувати зразки без додаткового очищення. Це вигідно відрізняє його від іонізації електроспреєм (ESI) - іншого білок-сумісного мас-спектрометричного методу. В ході мас-спектрометричного аналізу пептидів, що утворюються в процесі протеолізу білків, може бути отримана карта пептидних мас або пептидний мас-фінгерпрінт, тобто молекулярні маси пептидних фрагментів.
Часто, якщо амінокислотна послідовність досить унікальна, а точність визначення мас досить висока, карта мас може бути використана для ідентифікації білка по базі данних без проведення подальших досліджень. Якщо пошук в базі даних призводить до неоднозначних результатів, то використовується подальший мас-спектрометричний аналіз із застосуванням тандемної мас-спектрометрії (MC / MC) для визначення повної або часткової амінокислотної послідовності (сиквенс-мітка; для кожного пептиду в суміші. Це часто досягається за допомогою іонізації електроспреєм в комбінації з MC / MC (ESI-MS / MS), що зазвичай вимагає додаткового кроку очищення пептидів від присутніх солей і детергентів, які можуть викликати ослаблення сигналів пептидів.
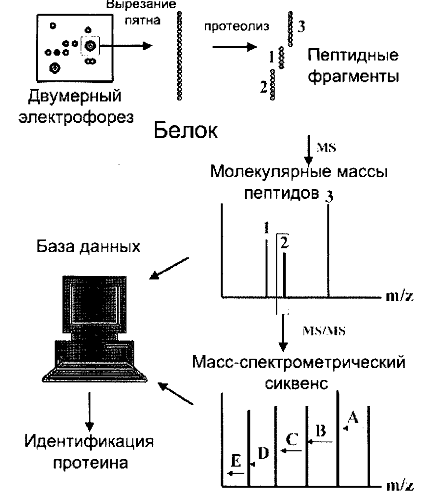
Рисунок 8 – Сучасна стратегія протеомного аналізу
Подальше дослідження баз даних по молекулярною ваг пептидів і частковим амінокислотним послідовностям має привести до однозначної ідентифікації білків і збільшення ефективності протеомного аналізу.
ВИСНОВКИ
Очищення біомолекул зазвичай досягається з використанням методів, які поділяють їх на основі відмінностей в цих фізичні властивості. Такими методами є іонний обмін, гель-фільтрація і афінна хроматографія.
Останнім часом пріоритетними завданнями в практиці мас-спектрометрії стали аналітичний контроль навколишнього середовища, дослідження лабільних органічних речовин і великих природних біомолекул, многокомпонентний аналіз складних сумішей органічних речовин, в тому числі ультраслідовий аналіз (10–9 – 10–15 г), встановлення будови великих органічнмх молекул, таких як вітаміни, пептиди, послідовності нуклеотидів і нуклеозидів, вивчення метаболізму і ін..
Аналітичне застосування мас-спектрометрії, вимагає отримання високої чутливості і селективності визначення, реалізується шляхом поєднання її з ефективними методами поділу, такими як газова і рідинна хроматографія, капілярний електрофорез.
ВИКОРИСТАНІ ДЖЕРЕЛА
- Волвенкин С. В. Характеристика ключевых ферментов глиоксилатного цикла в тканях крыс при голодании и экспериментальном диабете : дис. …кан.біол.наук. : ВАК РФ 03.00.04. Воронеж, 1999. 198 с. URL: https://www.dissercat.com/content/kharakteristika-klyuchevykh-fermentov-glioksilatnogo-tsikla-v-tkanyakh-krys-pri-golodanii-i-
2. Bisswanger Hans. Enzyme assays. Perspectives in Science. 2014. Vol.1, P. 41–55. DOI: https://doi.org/10.1016/j.pisc.2014.02.005
3. Северин С.Е. Биологическая химия : учебник / С. Е. Северин та ін. 3-е изд., испр. Москва : ООО «Изд-во «Мед. информ. агентство», 2017. 496 с.
4. Ферменти : методичний посібник для викладачів / К. В. Александрова
та ін. Запоріжжя : [ЗДМУ], 2015. 115 с.
5. Ганський Я. І., Максимчук Т. П. Біохімія людини : підручник. Тернопіль : Укрмедкнига, 2001. 736 с.
6. Солвей, Дж. Г. Наглядная медицинская биохимия : учебное пособие. пер. с англ. под ред. А. П. Вабищевич, О. Г. Терещенко ; под ред. Е. С. Северина. Москва : ГЭОТАР-Медиа, 2015. 159 с.
7. http://www.chem.msu.su/rus/vmgu/155/266.pdf
8. http://www.chemnet.ru/rus/jvho/2002-4/57.pdf
9. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4692135/
10. http://www.indiana.edu/~nimsmsf/P215/p215notes/LabManual/Lab4.pdf
Тестові питання до теми «Як найти фермент в тканинах та визначити його властивості»
- Вибрати вірну відповідь:
- Ферменти являються компонентами реакцій
- Прискорюють досягнення рівноваги збільшуючи швидкість тільки прямого перетворення.
- Прискорення реакції відбувається за рахунок підвищення енергії активації енергетичного бар'єру продукт реакції.
- Ферменти не являються компонентами реакцій та підлягають регенерації.
- Проявом високої специфічності ферментів є :
- зміна активності ферментів під впливом певних хімічних сполук
- їх стереоспецифічність
- важливими компонентами тварин, рослин і мікроорганізмів
- забезпечся необхідної швидкісті і координації біохімічних реакцій, що становлять обмін речовин (метаболізм)
3. Ферменти значно підвищують швидкість перебігу біохімічних реакцій одночасно:
- не змінюючи константу рівноваги (Кр) реакції та зменшуючи термін часу до досягнення стану рівноваги
- підвищуючи константу рівноваги (Кр) реакції та термін часу до досягнення стану рівноваги
- зменшуючи константи рівноваги (Кр) реакції та збільшуючи термін часу до досягнення стану рівноваги
-
не змінюючи константи рівноваги (Кр) реакції та термін часу до досягнення стану рівноваги
- Вставити пропущені терміни
Активність ферментів може суттєво змінюватися під впливом певних хімічних сполук, що збільшують (1-_________________) або зменшують (2-____________) швидкість реакції, яка каталізується
1- активатори; 2 – інгібітори
5. Кількість молекул субстрату, що перетворюється однією молекулою ферменту за хвилину, називають сукупністю обертів, або
- новою міжнародною одиницею катал
- питомою активністю ферменту
- молекулярною активністю ферменту
- швидкістю ферментативної реакції
6. В основі колориметричних методів лежить:
- вимірювання за допомогою ФЕК інтенсивності забарвлення речовини, яка утворюється під час взаємодії субстрату або продукту ферментативної реакції зі специфічними реактивами, які додаються у пробу після припинення реакції
- реєстрація поглинання світла в певних ділянках спектра коферментами, субстратами або продуктами реакції
- виділення ферментів з клітинного екстракту, який містить велику кількість інших компонентів.
- цей метод базується на використанні іммобілізованого ліганда, який специфічно взаємодіє з тим білком, який необхідно отримати в чистому вигляді
7. Для швидкого очищення білків успішним та ефективнішим є:
- осадження різними концентраціями солей (найчастіше сульфату амонію чи сульфату натрію) та органічними розчинниками
- гістохімічними методами
- метод афінної хроматографії
- вибіркову адсорбцію
8. Розподіл ферментів у субклітинних органелах вивчають після попереднього фракціонування клітинних гомогенатів шляхом
- вибіркової адсорбції та елюції білків з целюлозного аніонообмінника
- гель-фільтації
- осадженням різними концентраціями солей
- осадженням різними концентраціями органічних розчинників
- високошвидкісного центрифугування, визначаючи вміст ферментів у кожній фракції
9. В афінній хроматографії в якості лігандів найчастіше використовують:
- додавання антибіотика
- концентровані сольові розчини
- органічні розчинники (ацетон, етанол)
- похідні субстратів і коферментів
10. Методологія протеомного аналізу включає технологію (вибрати вірне)
- двовимірний електрофорез та мас-спектрометрію
- ПЛР-методи та blot-метод
- ультрацентрифугування методом «крок-за-кроком» с подальшою афінною хроматографією
- протоколом застосування методів гістоензимології


про публікацію авторської розробки
Додати розробку
