Методична розробка заняття (лекція)
ТзОВ Медичний коледж «Монада»
Первомайська філія
Методична розробка
заняття (лекція)
з теми:
«Розчини. Способи їх приготування та зберігання. Охорона праці під час приготування розчинів кислот, лугів. Обчислення.»
Автор: : Паращук А.В.
викладач техніки лабораторних робіт.
м. Первомайськ 2018р.
Тема: Розчини. Способи їх приготування та зберігання. Охорона праці під час приготування розчинів кислот, лугів. Обчислення.
І Підготовчий етап
Актуальність теми: Розчини різних речовин у воді і органічних розчинниках широко використовуються в лабораторній практиці (в біології та медицині), тому лабораторному техніку (експериментатору) необхідно вміти готувати розчини різних концентрацій. Розчини технічних і аналітичних концентрацій вимагають різної техніки приготування. Розчини, що вимагають високої точності приготування, називаються розчинами з аналітичними концентраціями. Такі розчини готуються з використанням точних розрахунків, аналітичних терезів, спеціального мірного посуду.
Мета: освітня: сформувати знання в учнів про способи вираження складу розчинів; ознайомити з поняттям «масова частка розчиненої речовини»; розширити знання про кількісний склад розчину;
розвиваюча: розвивати навички обчислення кількісного складу розчину; приготування розчину; розвивати логічне мислення, вміння та навички працювати з додатковою літературою та текстом підручника;
виховна: виховувати самостійність, почуття відповідальності за свої вчинки, бережне ставлення до здоров'я.
Методи і прийоми навчання: розповідь, пояснення, бесіда, інструктаж (інформаційно-рецептивні); самоконтроль, закріплення набутих знань (репродуктивні), проблемно-пошуковий (постановка проблемного питання); навчально-дослідницький, самостійна робота учнів
Базові поняття: розчин, розчинник, розчинена речовина, масова частка розчиненої речовини
Очікувані результати навчальних досягнень:
Студенти повинні знати: кількісний склад розчину
Студенти повинні вміти: розраховувати масову частку розчиненої речовини; масу розчиненої речовини за відомою масовою часткою, масу та об’єм води для приготування розчину із заданою масовою часткою
Тип заняття: проблемне
Епіграф до заняття
«Просто знати – це ще не все, знання потрібно використовувати»
(Гете)
ІІ. Міждисциплінарна інтеграція.
|
№ п/п |
Дисципліни |
Знати |
Уміти |
|
І. Попередні (забезпечуючі) |
|||
|
1
|
Неорганічна хімія
|
Поняття про розчини. Фізико – хімічні властивості лікарських речовин, здатність розчинятися в розчинниках, наявність окислювальних властивостей, можливість утворювати складні комплекси у розчинах. |
Визначати фізико – хімічні властивості компонентів пропису, розчинність у воді та інших розчинниках. Проведення окислювально – відновних реакцій.
|
|
2 |
Фізика |
Поняття про концентрацію розчину. Поняття про показник заломлення у розчині. |
Користуватися рефрактометром для визначення концентрації речовин у розчинах. Користуватися формулою для визначення концентрації речовини у розчині з використанням показника заломлення. |
|
3 |
Технологія ліків |
Особливі випадки виготовлення розчинів. Способи виготовлення концентрованих розчинів . |
Готувати розчини з лікарськими речовинами, які мають різні фізико – хімічні властивості, і виконувати додаткові технологічні прийоми. Готувати концентровані розчини різними способами. Використовувати концентровані розчини для приготування мікстур. |
|
II. Внутрішньопредметна інтеграція
|
|||
|
1 |
Техніка лабораторних робіт |
Способи приготування та зберігання розчинів. Приготування розчинів заданої концентрації. Важки та гирі. Методика зважування на терезах. Поняття про рефрактометричний метод аналізу. |
Виконувати основні технологічні операції по приготуванню розчинів. Правильно зважувати речовини на терезах. Користуватися рефрактометром для визначення концентрації речовин у розчинах. |
ІІІ. Основний етап
Хід заняття
IV. План проведення лекції
- Розчини. Загальна характеристика
- Класифікація розчинів
- Способи приготування та зберігання
- Обчислення розчинів
- Охорона праці під час приготування розчинів кислот, лугів
V.Зміст лекційного матеріалу
- Опитування студентів.
Для вивчення нової теми пригадаємо з курсів хімії та математики:
- що таке відсотки?
- як знаходять відсотки від числа?
- для чого і як обчислюють масові частки хімічних елементів у сполуц
- Які системи називаються розчинами?
- З яких компонентів складаються розчини?
- Чи є склад розчину постійним?
- Скільки видів розчиненої речовини і розчинника може бути в розчині?
- Який розчинник є універсальним?
ІІІ. . Мотивація навчальної діяльності
Людина в своєму житті використовує дуже багато різних розчинів. У повсякденному житті нерідко виникає потреба приготувати той чи інший розчин. Який же склад мають розчини? Як визначити кількості компонентів у розчині?
І найголовніше питання ,
Проблемне питання. Як часто у житті ми використовуємо розчини?
IV Вивчення нового матеріалу
Основний зміст теми
- Розчини . Загальна характеристика
Розчинами називають однорідні (гомогенні) системи, які складаються з двох або більше компонентів, відносна кількість яких може змінюватися в широких межах без порушення однорідності.
Компонентами розчину називають розчинник та розчинені в ньому речовини.
Під час вивчення дисципліни «Техніка ліків» ви вивчали вже питання,» що таке розчинник»? Повторимо/ конспект
Відповідь студентів
Розчинник— це середовище, в якому розчинені речовини рівномірно розподілені у вигляді молекул або йонів.
Розчинником прийнято вважати компонент, агрегатний стан якого не змінюється при утворенні розчину або вміст якого переважає вміст інших компонентів. Поняття розчинник і розчинена речовина умовні. Наприклад, при змішуванні чистої води та твердої речовини солі одержують рідкий розчин. У даному випадку розчинником є вода. Якщо обидва компоненти до розчинення перебували в одному агрегатному стані, то розчинником вважається компонент, взятий у більшій кількості, а якщо їхні об'єми однакові, то байдуже, який із компонентів називати розчинником, а який розчиненою речовиною.
Основні параметри стану розчину — це температура, тиск та концентрація.
Залежно від концентрації розчиненої речовини розчини поділяють на розведені та концентровані.
Розведений розчин містить зовсім малу масу розчиненої речовини порівняно з масою розчинника.
Наприклад, у 100 г води розчинено 5 г хлороводню. Розчин, який містить 36,5 г хлороводню в 100 г води, вважають концентрованим.
Межі між розведеними та концентрованими розчинами умовні. Наприклад, для сульфатної кислоти концентрованим вважається розчин, який містить 96 г Н2SО4, для хлоридної — 37г НС1 у 100 г води
Кількість розчиненої речовини, що міститься в даній кількості розчину або розчинника, називають його концентрацією.
Кількісний склад розчину
Під час роботи з розчинами важливо знати їхній кількісний склад, зокрема масову частку розчиненої речовини. Цю важливу кількісну характеристику завжди зазначають на етикетках хімічних реактивів, харчових продуктів, лікарських засобів у формі розчинів.
Наведіть приклади з позначенням складу розчину.
(Відповіді учнів)
Хочу зазначити, що багато з вас спостережливі і вмієте уважно читати етикетки.
Кількісна характеристика зазначена на етикетках означає, наприклад, масова частка йоду в його спиртовому розчині становить 5 %; масова частка амоніаку в його водному розчині - 10 %; масова частка оцтової кислоти у столовому оцті – 9 %, а масова частка гідроген пероксиду в його водному розчині - 3 % .


![]()
![]()
![]()
![]() 5% 5% 10% 9% 3%
5% 5% 10% 9% 3%


- Масова частка розчиненої речовини в розчині
а) Пояснення вчителя
Склад розчину кількісно виражається співвідношенням кількості розчиненої речовини й розчинника. Розчин складається з розчиненої речовини та розчинника (для двокомпонентних систем), маса розчину являє собою суму мас розчиненої речовини та розчинника:
m(р-ну) = m (р. р.) + m (р-ка)
З питанням масової частки розчиненої речовини зустрічалися на курсі хімії. Повторимо Відповідь студентів/ конспект
Масова частка розчиненої речовини у розчині позначається - W (дубль-ве)
Масова частка розчиненої речовини - це фізична величина, що дорівнює відношенню маси компонента mр.р. до маси розчину m р-ну і визначається за формулами:
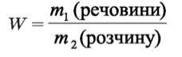
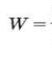
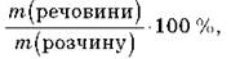
Масова частка — безрозмірна величина. Виражається у частках одиниці або відсотках. Наприклад, масова частка дорівнює 0,06, або 6 %. Так, запис «масова частка кислоти у водному розчині становить 15%», означає, що у 100 г розчину міститься кислоти 15% і 85% води, а за масою 15 г кислоти і 85 г води.
Алгоритм для обчислення масової частки розчиненої речовини
- Прочитайте текст задачі. Проаналізуйте, що відомо і що необхідно знайти.
- Запишіть стисло умову і вимоги задачі
- Запишіть формулу для обчислення масової частки розчиненої речовини:
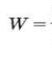
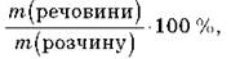
- За необхідності, обчисліть масу розчину за формулою:
m(р-ну) = m (р. р.) + m (р-ка)
- Обчисліть масову частку розчиненої речовини
- Запишіть відповідь
Знання масової частки розчиненої речовини часто використовують для обчислень, пов’язаних із приготуванням розчинів: із чистої речовини та води, розведення розчинів певної концентрації тощо. Але на практиці зручніше вимірювати об’єм розчину, а не його масу. Як ви знаєте, ці величини пов’язані через густину ρ:
З курсу фізики згадаємо формулу густини та основні характеристики.
![]()
Густину розчинів зазвичай виражають у грамах на мілілітр (г/мл):
1 мл = 1 см3, 1 л = 1 дм3 = 1000 см3.
Значення густини чисельно дорівнює масі розчину (в грамах), що займає об’єм 1 мл. Густина води дорівнює:
1 г/мл, тобто 1 мл води важить 1 г.
Титр розчину (Т) показує, скільки грамів або міліграмів розчиненої речовини міститься в 1 мл розчину/ Одиниці виміру — г/мл або мг/мл
- Класифікація розчинів
Розчини класифікують за рядом ознак:
— залежно від природи розчинника розчини поділяють на водні та неводні (спиртові, бензольні тощо);
— залежно від концентрації йонів гідрогену розчини можуть бути кислими, нейтральними та лужними
— залежно від агрегатного стану розчинника та розчиненої речовини розчини поділяють на газоподібні, рідкі та тверді.
Прикладом газоподібних розчинів є повітря. Воно складається з азоту, кисню, оксиду карбону (IV), водяної пари та благородних газів. Молекули цих речовин, незалежно від їхнього походження, поводять себе як молекули газу, тобто повітря є гомогенною системою.
До твердих розчинів належить більшість металевих сплавів. Сталь, наприклад, є кристалічним розчином карбону в залізі.
- Способи приготування та зберігання розчинів
Основні правила приготування розчинів
- Для приготування розчинів застосовують тільки чисті розчинники. Посуд повинен бути також чистим.
- Слід підготувати дві посудини: одну - для розчинення, другу - для зберігання.
- Необхідно запобігти потраплянню в приготовлені розчини пилу чи газів, з якими можуть реагувати деякі розчини.
- Пляшки або інший посуд повинні бути закриті добре підігнаними пробками.
- Розчини лугів захищають від двоокису вуглецю, обладнавши пляшки хлоркальцієвою трубкою, яка заповнюється натронним лугом.
- Лужні розчини не можна залишати надовго у фарфоровому і особливо в скляному посуді.
Зберігання розчинів.
Виготовлення розчинів потребує точності, акуратності й попереднього проведення правильних математичних розрахунків. Усі ці якості та вміння знадобляться вам не лише під час виконання лабораторних дослідів по приготуванню розчинів, а й у повсякденному житті.
Запам'ятайте! Тривале й неправильне зберігання може призвести до псування розчину аж до повної непридатності - появи пластівців і каламуті, зміни кольору й складу, тощо.
Зберігання пожежо небезпечних реактивів
Пожежо небезпечні реактиви здатні до мимовільного займання, загоряння, вибуху від впливу тепла, електричної іскри, удару, тертя, стиснення, при з'єднанні з водою і т. п. Пожежо небезпечні реактиви необхідно зберігати в окремому приміщенні, подалі від нагрівальних приладів, враховуючи можливість їхнього мимовільного запалення, або вибуху використовуючи спеціальне лабораторне обладнання .
Зберігання токсичних реактивів
Токсичні реактиви при попаданні в організм, на шкіру, або слизові людини, роблять особливо шкідливий вплив, порушуючи діяльність органів, або приводячи до їх загибелі. Токсичні реактиви групи сильнодіючих отруйних речовин зберігаються за зазначеними правилами.
- Обчислення розчинів
Визначення масової частки розчиненої речовини в розчині
Розв'язування задач
Задача 1
Обчисліть масову частку розчиненої речовини в розчині, який утворюється в результаті змішування 20 г цукру і 180 г води.
Алгоритм для обчислення масової частки розчиненої речовини (Додаток 2)
![]() Дано: Розв'язання
Дано: Розв'язання
m(цукру)=20 г 1) Визначаємо масу розчину за формулою:
m(Н₂О)=180 г m(р-ну) = m (р. р.) + m (р-ка)
![]() Знайти: m (р. цукру) = 20+180 = 200 (г)
Знайти: m (р. цукру) = 20+180 = 200 (г)
W(цукру)-? 2) Визначаємо масову частку цукру у розчині за формулою: 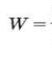
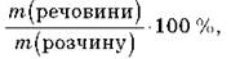
W(цукру) = 20 : 200 х 100;
W(цукру) = 10%
Відповідь: W (цукру)=10%
Задача 2
Визначити масу кухонної солі в розчині масою 120 г з масовою часткою солі 10%.
![]() Дано: Розв'язання
Дано: Розв'язання
m(р. солі)=120 г Визначаємо масу розчиненої речовини у
![]() W(солі)=10% розчині:
W(солі)=10% розчині:
Знайти: m(р.р.) = m(р-ну) х W(р.р.) : 100%
m(солі) - ? m(солі) = 120 г х 10% : 100%
m(солі) = 12 г
Відповідь: m(солі) = 12 г
Запам'ятайте! Важливо уважно читати етикетки на споживчих товарах. Не сплутайте, наприклад, столовий оцет, масова частка оцтової кислоти в якому не перевищує 9 %, з оцтовою есенцією в якій масова частка оцтової кислоти в ній становить 40 %. Помилкове вживання оцтової есенції замість столового оцту може спричинити важкі хімічні опіки органів травлення.
- Виготовлення розчину.
(Пояснення, демонстрація)
а) Повторення правил техніки безпеки під час проведення хімічного експерименту - приготування розчинів .
Охорона праці під час приготування розчинів кислот, лугів
(Доповідь студента)
(Не можна брати реактиви руками, обережно працювати зі скляним посудом, стежити, щоб приготовлені розчини не потрапили на одяг, шкіру, в очі) (Колективне обговорення)
Для виготовлення розчину з певною масовою часткою розчиненої речовини необхідно:
- речовина, яку розчиняють;
- розчинник;
- посуд для виготовлення розчину (хімічний стакан, колба, мірний циліндр);
- ложечка для насипання речовин;
- скляна паличка для перемішування розчину (прискорити розчинення речовини);
- терези, різноважки;
- мірний циліндр
- за необхідності фільтрувальний папір, лійка, ступка з товкачиком
Щоб приготувати розчин необхідно провести обчислення маси розчиненої речовини та розчинника, потім визначити об’єм розчинника. На терезах зважити масу розчиненої речовини, мірним циліндром відміряти певний об’єм розчинника. Розчинену речовину висипати у хімічний стакан, долити розчин-ник. Для прискорення розчинення суміш перемішати скляною паличкою. Перед виготовленням розчинів тверді речовини зазвичай подрібнюють. За потреби (поясніть, коли вона виникає) готовий розчин фільтрують.
Задача №2. Виготовити 20 г розчину кухонної солі (натрій хлориду) з масовою часткою розчиненої речовини 5%.
План виготовлення розчину
|
Послідовність роботи |
Обчислення |
|
m(солі) = 20 х 0, 05 = 1 г |
та об’єм розчинника (дистильованої води) |
а) m (р-ка) = m(р-ну) - m (р. р.) m(Н₂О) = 20 – 1 = 19 (г) б) ρ(Н₂О) = 1 г/мл V(Н₂О) = m:ρ = 19 г : 1 г/мл = 19 мл |
солі і висипаємо у хімічний стакан (колбу) місткістю 100 мл |
|
обережно по скляній паличці для перемішування виливаємо її у хімічний стакан з сіллю |
|
|
|
У хімічних лабораторіях навчальних закладів порції твердих речовин зважують на терезах із погрішністю (для навчальних цілей) не більш 0,1-1 г. У хімічних і фармацевтичних лабораторіях використовують високоточні електронні терези. Розчинення здійснюють у чистому посуді, який не взаємодіє з розчином.
ІV. Систематизація та узагальнення знань студентів
Прийом «Перетвори інформацію на знання»
Вибрати правильне твердження.
- Масова частка розчиненої речовини - це:
А Відношення маси розчину до маси розчиненої речовини;
Б Відношення маси розчинника до маси розчину;
В Відношення маси розчиненої речовини до маси розчинника;
Г Відношення маси розчиненої речовини до маси розчину.
- Масову частку розчиненої речовини позначають літерою:
А m; Б w; В Mr; Г Ar.
- Масову частку розчиненої речовини виражають у:
А Грамах; Б Відсотках; В Градусах; Г Літрах;
V. Підведення підсумків заняття
На сьогоднішньому занятті ми розглянули масову частку і масу розчиненої речовини в розчині та ознайомилися з правилами виготовлення розчину.
«Чорна скринька»
Завдання для І групи.
Із історії відомо, що через цю речовину виникали бунти. Астрономи кажуть, що із цією речовиною, пов’язана назва частини нашої Галактики, яка називається “Чумацький шлях». Багато людей платять великі гроші, щоб зануритися у цей розчин. Деяким хворим вводять 0,85% розчин цієї речовини, який називають «фізіологічним». Без неї борщ – не борщ, і каша – не каша. Вона настільки важлива, що з нею пов’язані різні приказки, загадки, прислів’я. Наприклад, у воді росте, у воді кохається, у воду впаде – води злякається (кухонна сіль).
Розрахуйте масову частку солі, якщо для приготування 200 г розчину взяли кухонну сіль масою 15 г.
Розв’язання
т розчиненої речовини * 100%
w (реч)= ----------------------__(у відсотках)___
т розчину
w (реч)=15*100/200=7,5%.
Відповідь. Масова частка солі становить 7,5%.
Завдання для ІІ групи.
Ця речовина безбарвна. Під час першої світової війни виготовляли грілки для зігрівання поранених солдат при транспортуванні за таким рецептом: «Візьміть 1 кг залізних ошурків та 2 ложки цієї речовини». Це її називають сестрою Гримучого газу і дочкою короля Окса. Це про цю речовину співають в пісні, що вона греблю рве (вода).
Для підживлення капусти використовують 3%-ий розчин калій хлориду. Скільки води та солі необхідно для приготування 500 г такого розчину?
Розв’язання
т розчиненої речовини * 100%
w (реч)= ----------------------__(у відсотках)___
т розчину
т розчиненої речовини= w (реч)* т розчину/100
т(солі)=3*500/100=15 г
т(р-ну)=т(реч.)+т(р-ка)
т(води)=т(розчину)-т(розчиненої речовини)
т(води)=500-15=485 г
Відповідь. Для приготування 500 г такого розчину необхідно 15 г калій хлориду та 485 г води.


про публікацію авторської розробки
Додати розробку