Презентація Історія відкриттів лауреатів Нобілівської премії в галузі фізиології та медицини

















Історія вивчення механізмів передачі інформації в живих системах. На початку 50-х рр. біофізики Р. Франклін і М. Уілкінс отримали рентгенограми ДНК, які показали, що вона має форму подвійної спіралі. У 1962 р. Ф. Крик, Дж. Уотсон і М. Уілкінс отримали Нобелівську премію з фізіології і медицини за розшифровку будови ДНК.
Історія вивчення механізмів передачі інформації в живих системах. На початку 50-х рр. біофізики Р. Франклін і М. Уілкінс отримали рентгенограми ДНК, які показали, що вона має форму подвійної спіралі. У 1953 р. Ф. Крик, Дж. Уотсон і М. Уілкінс відкрили подвійну стркутуру ДНК. В 1962 р. отримали Нобелівську премію з фізіології і медицини за розшифровку будови ДНК.
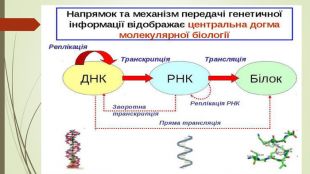
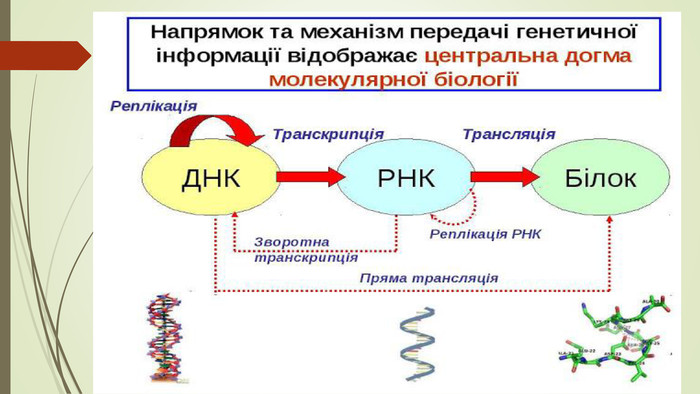
Центральна догма молекулярної біології Френсис Крик в 1958 році вперше ввів термін «Центральна догма молекулярної біології», який використовується і сьогодні для демонстрації одностороннього переходу генетично інформації за схемою: ДНК —> РНК — > білок«Інформація передається від нуклеїнових кислот до білку, але не в зворотньому напрямку». Крик вважав,що це правило не може бути спростовано. Ф. Крик зазначив три складові будь якого біологічного процесу: матеріальна, енергетична, інформаційна.
Але з кожного правила є виключення. Англійський біолог Горвард Матін Темін, вивчаючи проблеми раку, з’ясував, що якщо в процесі ділення здорових клітин відбувається вторгнення в сусідні тканини, то клітинна регуляторна система подає сигнал про припинення процесу ділення. Якщо ж клітка уражена, то при її вторгненні в сусідні тканини регуляторна система не діє. Темін припустив, що подібна трансформація викликається вірусним геном, що став частиною клітинної ДНК. Отже, білкова оболонка деяких вірусів містить фермент, що сприяє копіюванню генетичного коду РНК-вірусів у клітинну ДНК, чим забезпечує зворотню транскрипцію. Подальші дослідженя виявили,що ген провіруса, що активізувався, індукує синтез пухлиноутворюючих білків у клітці. Саме ці патологічні білки блокують надалі передачу сигналів обмеження клітинного зростання, внаслідок чого клтина починає безконтрольно розмножуватися. Нормальна клітина перетворюється в пухлину
Але це припущення суперечило центральній догмі Ф. Крика. Потрібно було підтвердити «провірусну гіпотезу», тобто знайти такий фермент експериментально. У 1970 Горвард Темін і Дейвід Балтімор незалежно один від одного виділили фермент зоротньої транскиптази який копіює вірусні РНК-гени в клітинну ДНК. Знов відкритий фермент назвали РНК-залежна-ДНК-полімераза. В1976 році вони отримали Нобелевську премію в галузі фізіології та медицини.
Дослідження зворотньої транскипції у 60-ті роки минулого століття проводилися в Радянському Союзі в Інституті мікробіології та вірусології АН України. Український вчений С. М. Гершензон, керівник Сектору молекулярної біології та генетики проводив дослідження в галузі зворотної транскрипції генетичної інформації (від РНК до ДНК). Дослідження цього теоретичного питання було надзвичайно важливим і пояснювало механізм дії онкогенних вірусів. Але довести теоретичні дослідження до кінця він не зміг.
. ЗВОРОТНА ТРАНСКРИПЦІЯ — процес синтезу ДНК з використанням РНК як матриці. Називається так тому, що в більшості живих організмів транскрипція відбувається в іншому напрямку, а саме — з молекули ДНК синтезується РНК-транскрипт. Вперше встановлена для одного з класів РНК-вмісних вірусів тварин (ретровірусів) і забезпечується вона спеціальним ферментом — зворотною транскриптазою. Зворотна транскриптаза (РНК-залежна ДНК-полімераза, або ревертаза). Ретровіруси викликають такі хвороби, як гепатит, деякі форми раку та СНІДу. Зворотня транскрипція виявлена також в клітинах бактерій, клітинах еукаріот, в тому числі і у людини.
Ензим (фермент), що регулює довжину теломер, називають теломеразою. Як ензим, теломераза є зворотною транскриптазою, що як матриця використовує зв’язану з нею особливу молекулу РНК, на якій проводить синтез ДНК для подовження теломер. Теломера (від грец. télos — «кінець» и méros — «частина») — ділянка ДНК, що складається із великого числа повторів та розташована на кінці лінійної хромосоми. Основна роль теломер — захист ДНК. Якби не специфічна структура теломер, кінці хромосоми розпізнавалися би клітиною, як дволанцюговий розрив ДНК, що вмикало б механізми ДНК репарації
Вивчення властивостей теломерази дає змогу зрозуміти, яким чином відбувається старіння клітин, як ракові клітини забезпечують собі «вічну молодість», і визначити шляхи пошуку нових протипухлинних ліків чи ліків, які гальмують старіння. Цілком реально, що в майбутньому можна буде через регуляцію активності теломерази цілеспрямовано відновлювати клітини й органи, що піддаються старінню, чи, навпаки, припиняти ріст і розмноження клітин, що активно розмножуються.
Відомі дані, щоправда, поки нечисленні, що «здоровий спосіб життя і харчування» зумовлює активацію теломерази та збільшення довжини теломер. І, навпаки, у людей із надмірною вагою або з інсулін-незалежним діабетом ІІ типу спостережено кореляцію зі швидкістю скорочення теломер. До скорочення теломер може призводити стрес, зокрема оксидативний. Чи не є це свідченням того, що ми самі часто скорочуємо власне життя, ведучи «нездоровий спосіб життя»? Цікаві також дані про позитивну кореляцію між рівнем вітаміну D в організмі людей і довжиною теломер лейкоцитів крові, що підтверджує думку про позитивний ефект впливу вітаміну D на процеси старіння тканин і на захворювання, пов’язанні зі старінням. Учені небезпідставно стверджують, що подібні відкриття можуть стати одними з перших на шляху до розгадки таємниці «вічно молодого» життя, про що є багато міфів і легенд.
Знання тонкої структури і механізмів функціонування рибосом безпосередньо пов’язане з можливістю регуляції біосинтезу протеїнів у клітині й розв’язанням багатьох медичних проблем. Більшість антибіотиків було створено таким чином, щоб вони гальмували синтез бактеріальних протеїнів на бактеріальних рибосомах і не перешкоджали синтезу протеїнів у клітинах організмів, де ці бактерії містяться. Таким чином, зрозуміло, чому протибактерійні антибіотики не активні проти вірусів: віруси не мають власних рибосом і власної протеїн-синтезувальної системи, але використовують рибосоми клітин господаря, де й розвиваються. Ада Йонат (Нобелевська премія 2009 року) була одним з піонерів в галузі дослідження рибосоми. Її дослідження впливу антибіотиків на рибосому і механізмів опору організму антибіотиків були важливим кроком у процесі вивчення клінічної ефективності лікарської терапії.
«RNA inter ference» — процес «сайленсингу» (чи інтерференції) синтезу протеїнів на рибосомах на основі двоспіральних «малих інтерферуючих» РНК, або мікро. РНК. Зрозуміти механізми, що «включають» та «виключають» гены, – означає отримати можливість управляти процесами ембріонального розвитку, старіния, тримати під контролем рак, більшість «спадкових" хвороб та ряд патологій, при яких в спадковий матеріал организму потрапляє чужеродна генетична інформація вірусної природи. Це відкриття створює можливості для цілеспрямованої регуляції, зокрема гальмування, синтезу окремих протеїнів і лікування багатьох захворювань людини, тварин і рослин.


про публікацію авторської розробки
Додати розробку