Презентація "Квантові постулати Бора"
Про матеріал
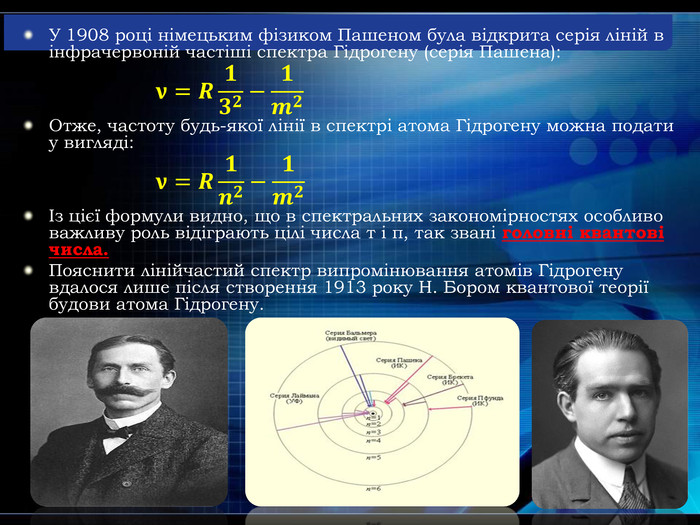
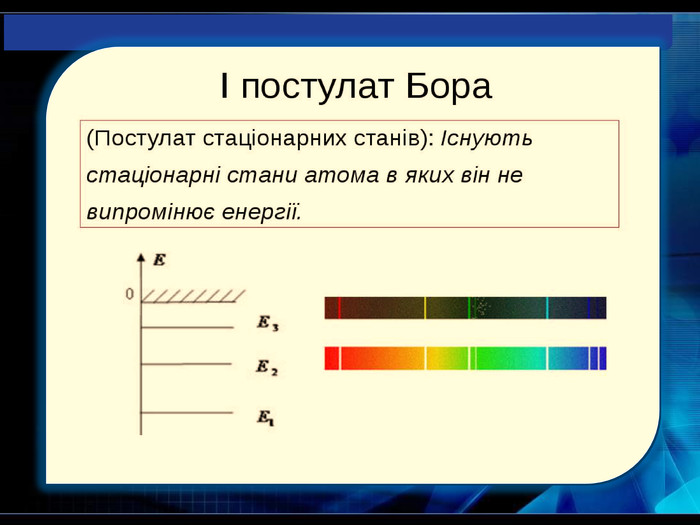
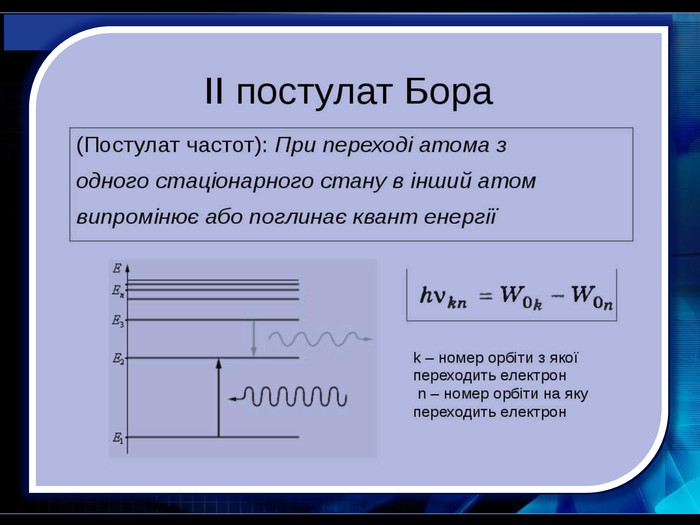
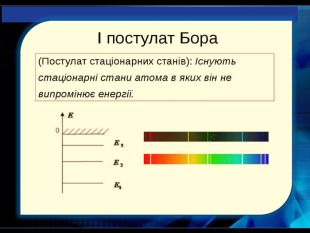
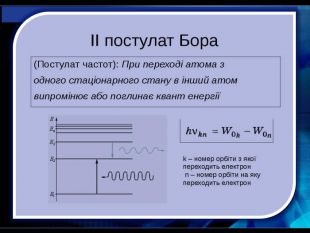
У 1885 році швейцарський фізик І. Бальмер довів, що всі частоти видимої частини спектра випромінювання атома Гідрогену можуть бути обчислені за дуже простою формулою (серія Бальмера). У 1908 році німецьким фізиком Пашеном була відкрита серія ліній в інфрачервоній частіші спектра Гідрогену (серія Пашена).Пояснити лінійчастий спектр випромінювання атомів Гідрогену вдалося лише після створення 1913 року Н. Бором квантової теорії будови атома Гідрогену. Спектральний аналіз - метод визначення хімічного складу речовини за його спектром.
Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки
pptx
До підручника
Фізика (рівень стандарту) 11 клас (Сиротюк В.Д., Баштовий В.І.)
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку

































-

Іменинник Людмила Миколаївна
03.02.2023 в 14:18
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Мар'єнко Юлія Павлівна
04.05.2022 в 11:00
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Без'язична Світлана Володимирівна
10.04.2022 в 11:54
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Малиновська Марина Василівна
27.05.2020 в 10:48
ДЯКУЮ!
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 1 відгук