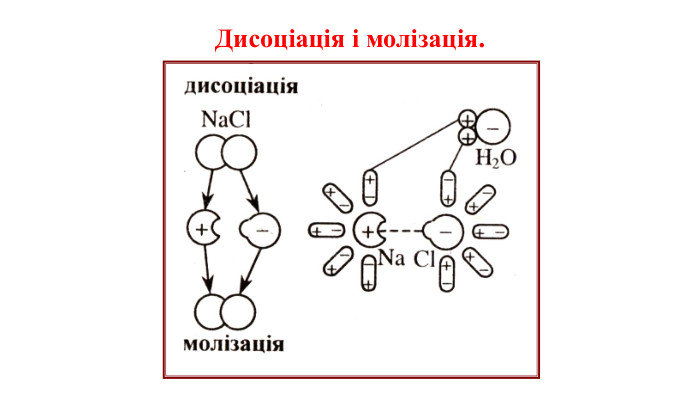
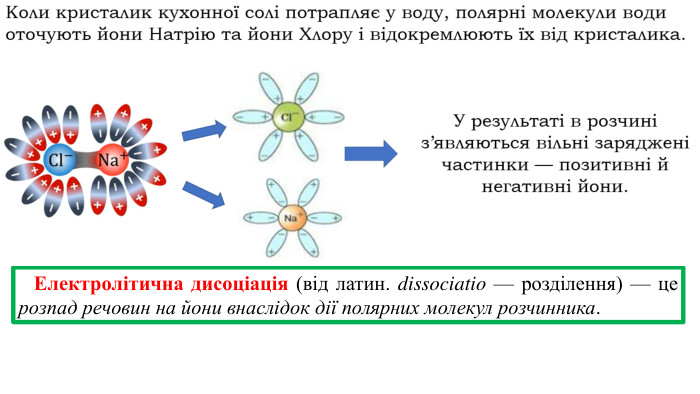
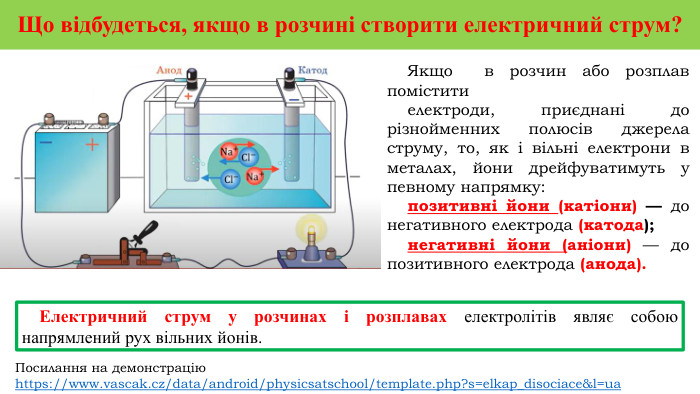
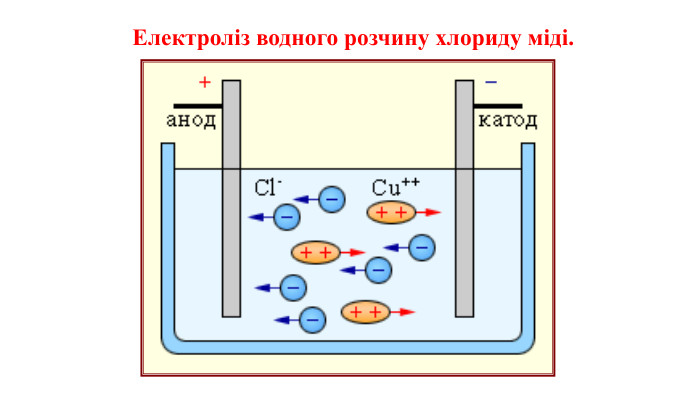
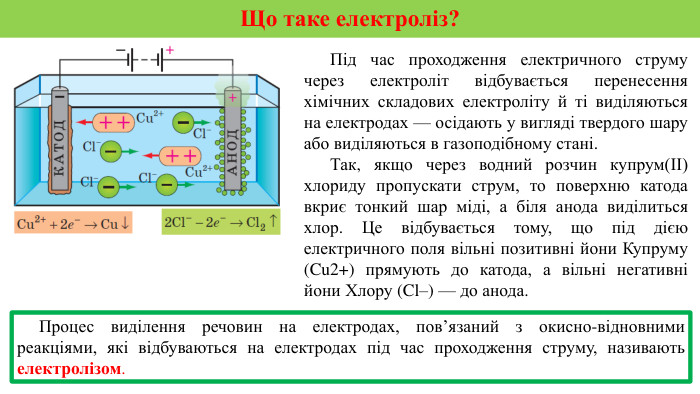
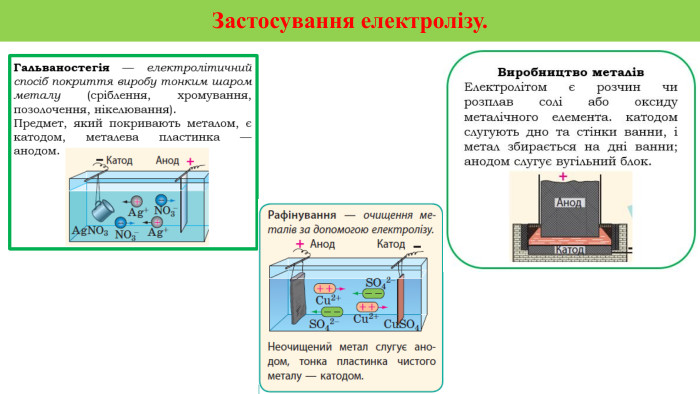
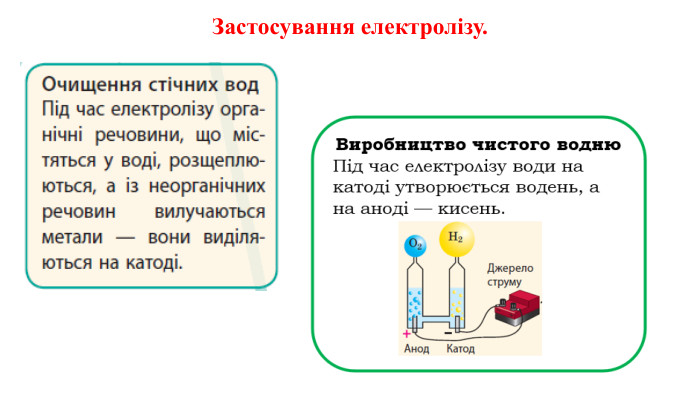
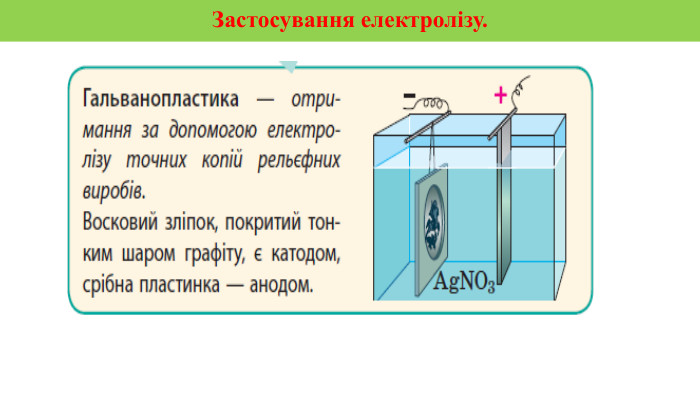
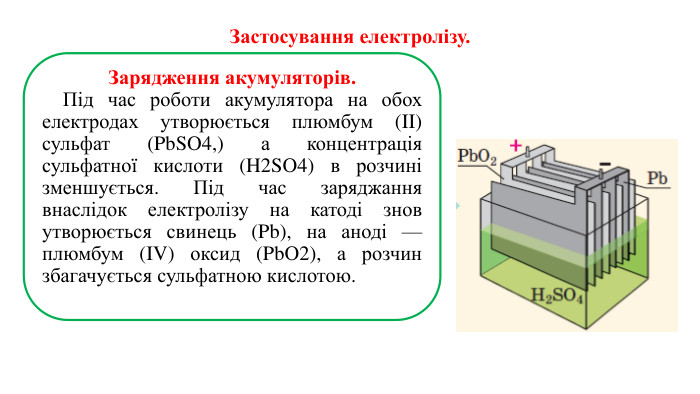
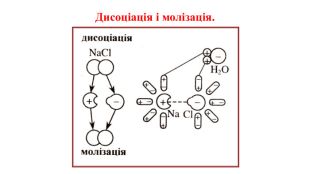
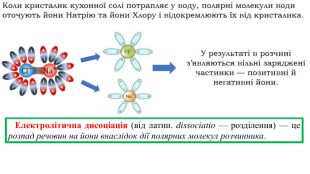
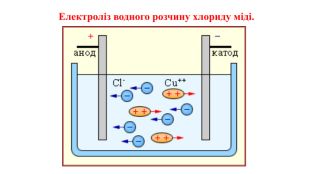
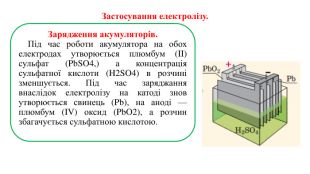
Презентація на тему "Електричний струм у розчинах і розплавах електролітів. Електроліз і його закони. Застосування електролізу."
Про матеріал
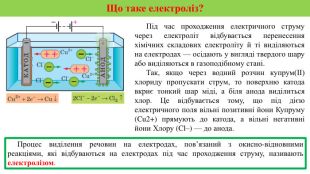
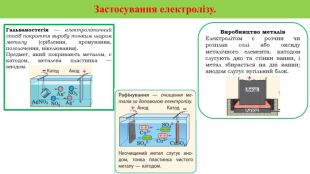
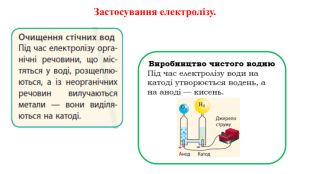
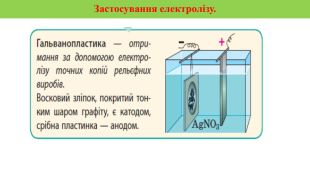
Презентація на тему "Електричний струм у розчинах і розплавах електролітів. Електроліз і його закони. Застосування електролізу." призначена для пояснення електрчного струму в розчинах і розплавах електролітів; явища електролізу та його законів, а також застосування електролізу. Перегляд файлу
Зміст слайдів
pptx
До підручника
Фізика 8 клас (Бар’яхтар В. Г., Божинова Ф. Я., Довгий С. О., Кі-рюхіна О.О. (за ред. Бар’яхтар В. Г., Довгого С.О.))
До уроку
§ 37. Електричний струм в електролітах Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку