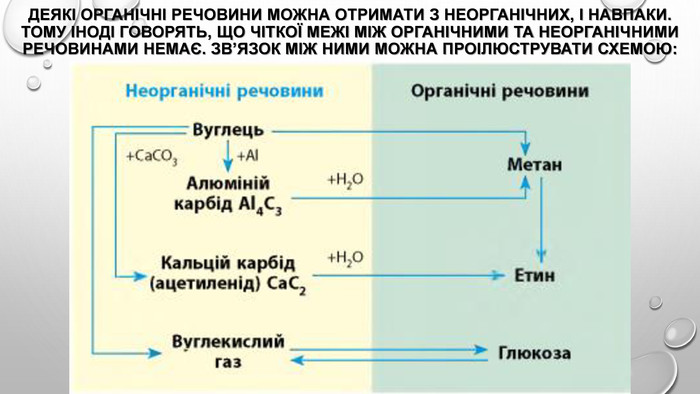
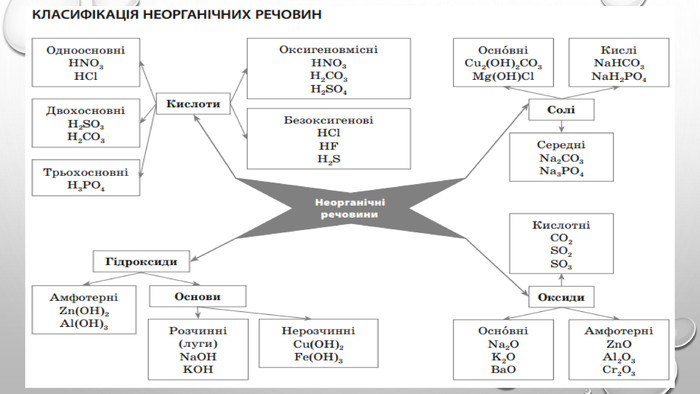
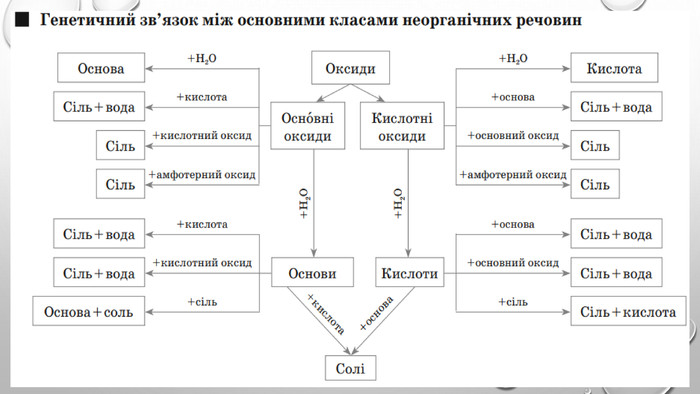
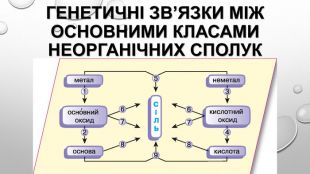
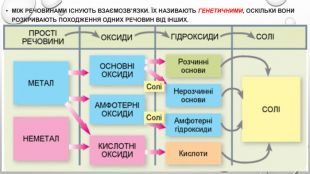
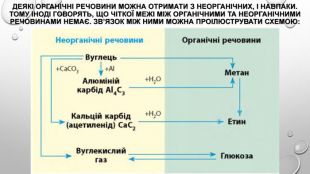
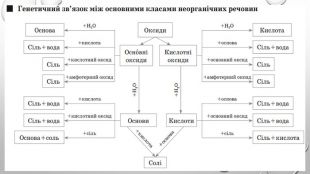
Презентація з теми: "Генетичні зв’язки між основними класами неорганічних сполук"
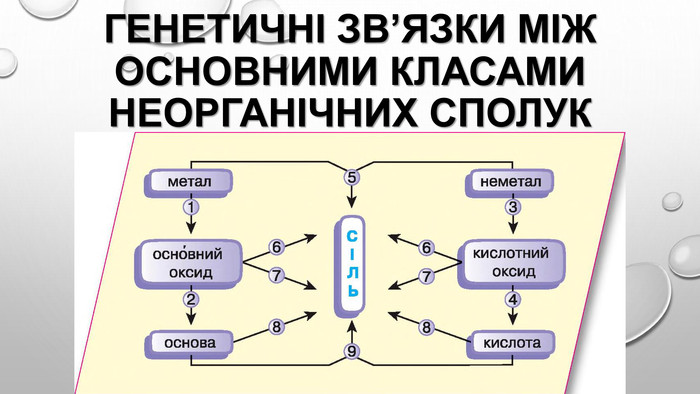

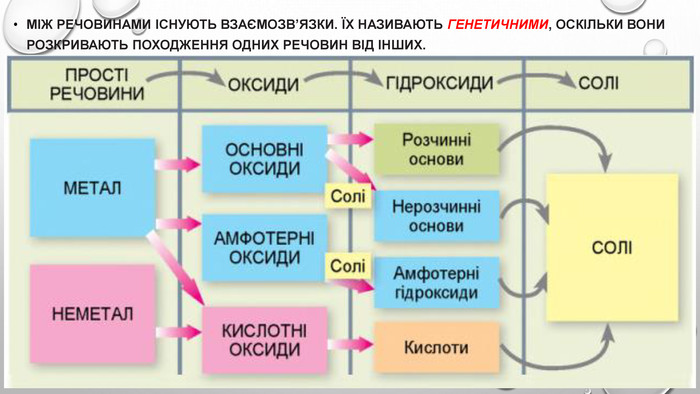
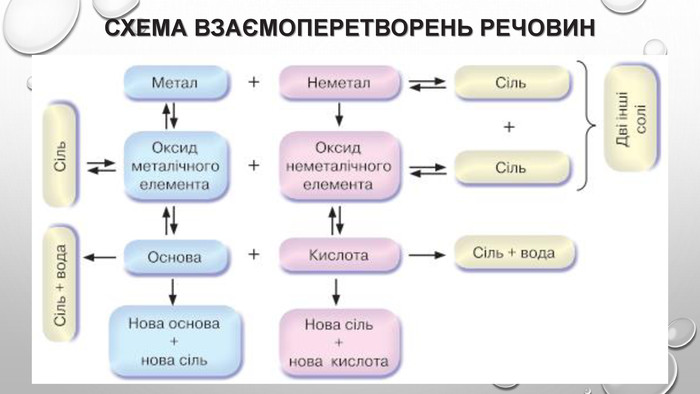
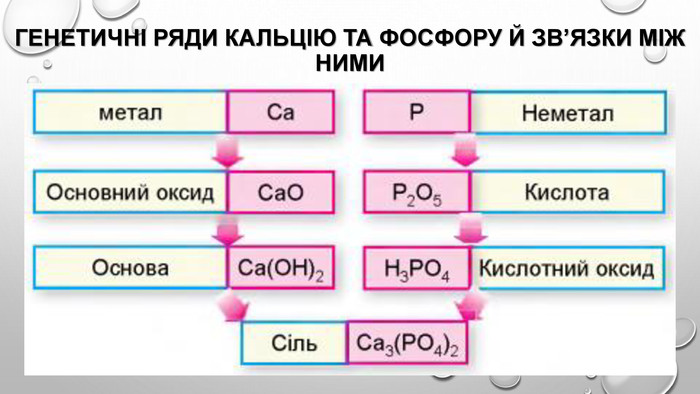
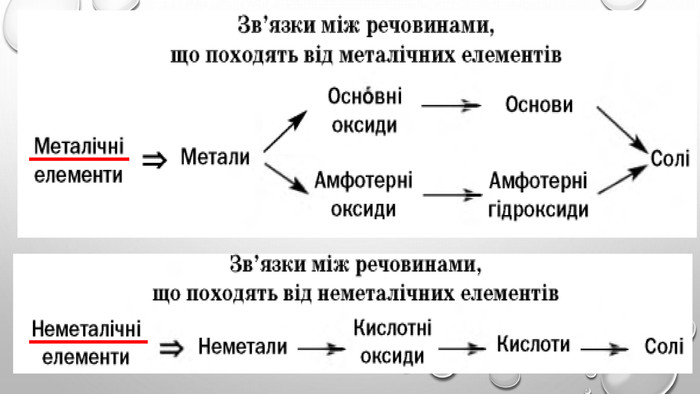
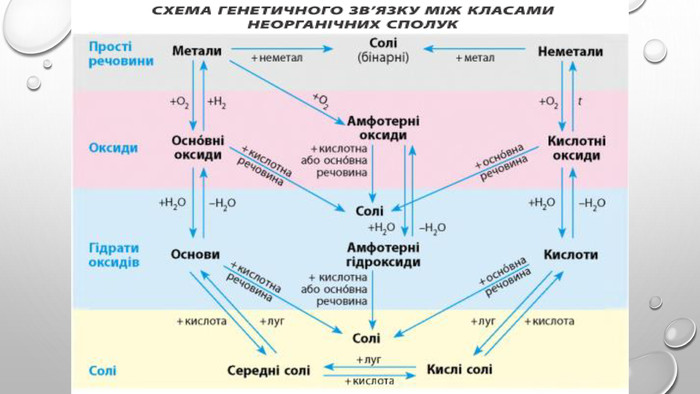






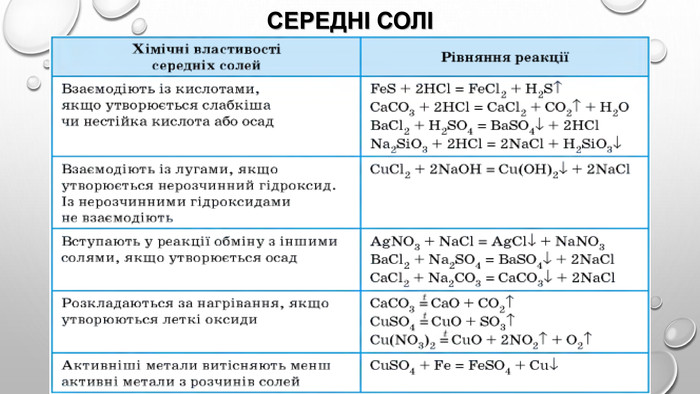
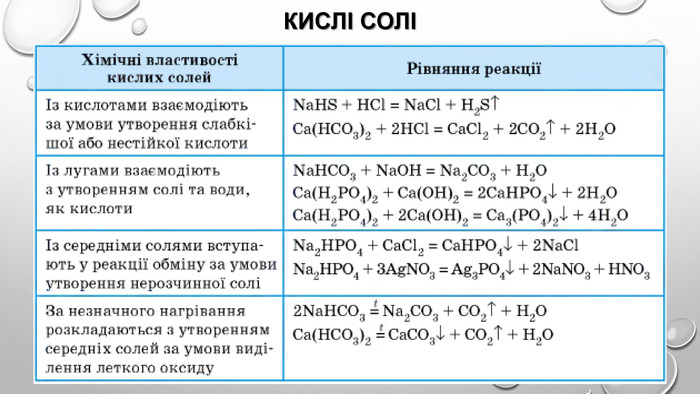






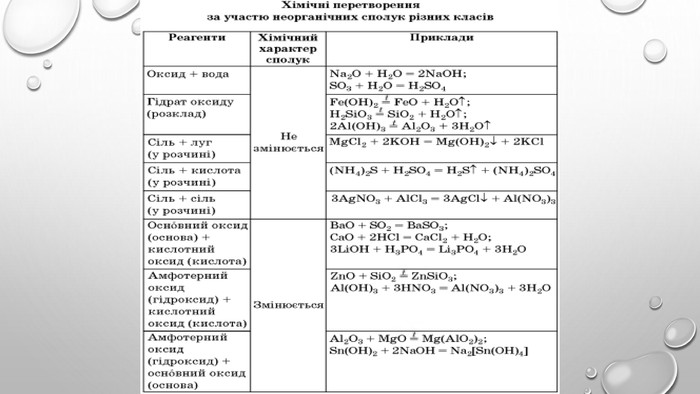
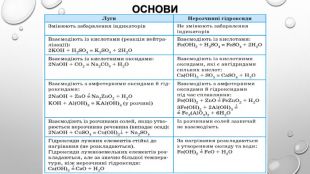
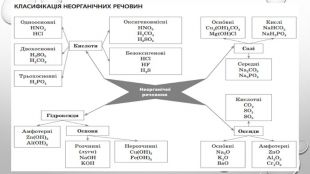
Амфотерні гідроксиди. Амфотерними є сполуки, що взаємодіють із речовинами як кислотної, так і основної природи. Алюміній, Цинк і деякі інші елементи утворюють амфотерні оксиди та гідроксиди. Амфотерні гідроксиди виявляють усі властивості нерозчинних гідроксидів. їхні особливості проявляються у взаємодії з основними речовинами. Під час сплавляння з основними оксидами або гідроксидами утворюються сіль (цинкат або алюмінат) та вода: У випадку алюміній гідроксиду залежно від співвідношення лугу й оксиду утворюються два типи солей — метаалюмінат та ортоалюмінат:• за нестачі лугу: • за надлишку лугу: Свіжоприготовлений алюміній та цинк гідроксиди активно взаємодіють із розчинами лугів за звичайних умов: Залежно від концентрації лугу алюміній гідроксид може утворювати два різні продукти:
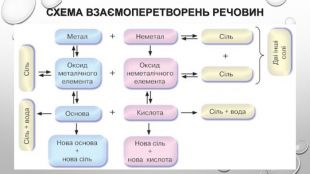
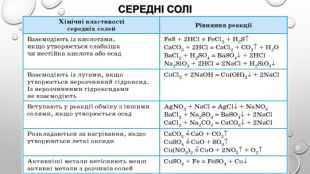
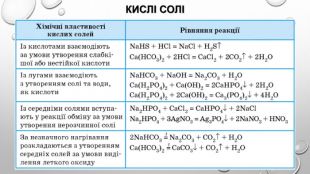
узагальнення1. Знайдіть відповідність:2. Назвіть два кислотних оксиди, взаємодія яких з водою є оборотною реакцією. Запишіть відповідні хімічні рівняння.3. Складіть рівняння усіх можливих реакцій між двома оксидами, використавши такий перелік сполук: Zn. O, Mg. O, Р2 О5, SО3, Li2 О.4. За яких умов відбувається реакція між натрій хлоридом і сульфатною кислотою? Дайте обґрунтування й запишіть відповідне хімічне рівняння.5. Нітратна кислота взаємодіє з барій карбонатом, але не реагує з барій хлоридом і барій сульфатом. Поясніть ці факти і напишіть хімічне рівняння в молекулярній і йонно-молекулярній формах.6. Солі Ag2 S і Na. NО3 не вступають у реакції обміну з іншими солями. Наведіть відповідні пояснення.7. Напишіть рівняння реакцій для здійснення таких перетворень:
8. Унаслідок взаємодії 10,7 г амоній хлориду з достатньою кількістю концентрованого розчину лугу добули 4,03 л амоніаку (н. у.). Обчисліть відносний вихід цього продукту реакції.9. Суміш 27,6 г калій карбонату і 7,1 г фосфор(У) оксиду нагріли до завершення виділення газу. Що являв собою твердий залишок після реакції? Обчисліть масові частки речовин у ньому. 10. Складіть рівняння реакцій за наведеними схемами:
12. Складіть чотири неоднотипних рівняння хімічних реакцій, у результаті яких утворюється вуглекислий газ.13. Складіть чотири неоднотипних рівняння хімічних реакцій, у результаті яких утворюється кальцій сульфат.14. Складіть молекулярні рівняння реакцій, за такою схемою: 15. Дано речовини: сульфатна кислота, цинк, вода, купрум(ІІ) оксид. Як із цих речовині продуктів їхньої взаємодії добути дві прості й чотири складні речовини?16. Складіть якомога більше рівнянь реакцій добування ферум(ІІ) сульфату.17. Cкладіть самостійно декілька схем генетичних зв’язків між зазначеними речовинами й напишіть відповідні рівняння реакцій: ферум(ІІ) оксид, ферум(ІІІ) хлорид, ферум(ІІ) гідроксид, ферум(ІІ) нітрат, залізо, ферум(ІІІ) оксид, ферум(ІІІ) сульфат, ферум(ІІІ) гідроксид.18. Доведіть експериментально, що з міді певними перетвореннями можна отримати дві солі різними способами.
19. До розчину, що містив натрій гідроксид кількістю речовини 0,1 моль, долили розчин сульфатної кислоти кількістю речовини 0,1 моль. Обчисліть масу утвореної солі. Назвіть сіль.20. До розчину, що містив ортофосфатну кислоту кількістю речовини 0,2 моль, долили розчин калій гідроксиду кількістю речовини 0,3 моль. Обчисліть масу кожної солі в утвореній суміші після випарювання продуктів реакції і назвіть солі. 21. запишіть схему перетворень у вертикальному стовпці схеми, починаючи з металу, і в першому горизонтальному рядку: 22. У природних водах Ферум міститься переважно у складі ферум(ІІ) гідрогенкарбонату, який за наявності води й кисню перетворюється на ферум(ІІІ) гідроксид і вуглекислий газ. Складіть рівняння цієї реакції, позначте окисник і відновник. 23. Складіть рівняння реакцій гідролізу таких солей: ферум(ІІ) хлорид, ферум(ІІ) сульфат, ферум(ІІІ) нітрат, ферум(ІІІ) бромід.
24. Складіть рівняння реакцій, що відповідають перетворенням:25. У природних водах Ферум міститься переважно у складі ферум(ІІ) гідрогенкарбонату, який за наявності води й кисню перетворюється на ферум(ІІІ) гідроксид і вуглекислий газ. Складіть рівняння цієї реакції, позначте окисник і відновник.


про публікацію авторської розробки
Додати розробку















-

Підкалюк Любов Петрівна
11.07.2025 в 13:47
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Грищенко Ирина
25.03.2025 в 13:17
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Сотникова Наталья
03.05.2023 в 19:54
Дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Колесник Наталія Іванівна
01.05.2023 в 12:12
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Шевченко Любовь
14.04.2023 в 16:39
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Дирбаба Ольга Георгіївна
01.02.2023 в 13:09
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Теребіленко Людмила Володимирівна
24.04.2022 в 18:20
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Переверзєва Інна
17.04.2022 в 21:02
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Арсенюк Наталія
06.04.2022 в 16:03
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
-

Товстолес Лариса
15.04.2021 в 10:45
дякую
Загальна:
5.0
Структурованість
5.0
Оригінальність викладу
5.0
Відповідність темі
5.0
Показати ще 7 відгуків