Тести "Періодичний закон і Періодична система хімічних елементів"
Тестовий контроль знань з теми «Періодичний закон та Періодична система хімічних елементів.» 11 клас
Варіант 1
1.Укажіть кількість р-електронів на зовнішньому електронному шарі атома Сіліція
а) два; б) один; в) чотири; г) три.
2. Принцип найменшої енергії полягає в:
а) Електрони розміщуються в атомі так, щоб їхня енергія була мінімальною;
б) Використовуючи періодичний закон, можна прогнозувати хімічний характер елементів;
в) Номер енергетичного рівня вказує на кількість підрівнів у ньому
3. Електрони, які заповнюють останній енергетичний рівень, називають
а)нестійкими; б)зовнішніми; в) внутрішніми.
4. Укажіть кількість електронних шарів у атомі елементу № 25
а) два; б) один; в) чотири; г) три.
5. Визначте елемент, електронна формула якого має вигляд 1s22s22p5
а) Хлор; б) Оксиген; в) Флуор ; г) Неон.
6.Вкажіть порядкові номера елементів, у яких на зовнішньому рівні один неспарений електрон:
а) 11; б) 19; в) 32; г) 30.
7. Вкажіть кількість електронів хімічних елементів, що належать до однієї групи: а) 15; б) 12; в) 19; г) 33.
8. Скільки всього електронів міститься на третьому енергетичному рівні:
а) 2; б) 8; в) 18; г)32.
9. Чи правильним є визначення: Атом — найменша електронейтральна частинка речовини, яка складається з позитивно зарядженого ядра і негативно заряджених електронів: а) так; б) ні.
10. Можливі ступені окиснення Нітрогену
а)+4- -4; б) -3 - +5; в)-1 - +7.
11. Установіть відповідність між символом елементу та числом неспарених електронів у його атомі
|
Символ елемента |
Число неспарених електронів |
|
А) С1 |
1. один |
|
Б) С |
2. два |
|
В) Р |
3. три |
|
|
4. чотири |
|
|
5. п’ять |
12. Установіть відповідність між електронною формулою елементу і його положенням в періодичній системі
|
Електронна формула елементу |
Положення в періодичній системі |
|
А 1s22s22p63s23p64s23d3 |
1) 3 період, ІІІ група |
|
Б 1s22s22p63s22p1 |
2) 4 період, ІІІ група, головна підгрупа |
|
В 1s22s22p63s23p64s23d104p3 |
3) 4 період, V група, А |
|
|
4) 4 період, V група, Б |
Тестовий контроль знань з теми «Періодичний закон та Періодична система хімічних елементів.» 11 клас
Варіант 2
1. Укажіть кількість електронів на s-підрівні
а) два; б) один; в) вісім; г) шість.
2.Укажіть характеристику атому, що зростає від Літію до Флуору
а) радіус; б) електронегативність ; в) число неспарених електронів;
г) валентність у водневих сполуках.
3. Укажіть автора ядерної теорії будови атома
а) Паулі ; б) Резерфорд; в) Бор; г) Мендєлєєв.
4.Виберіть елемент, атом якого має найбільший радіус
а) Натрій; б) Калій ; в) Кальцій; г) Аргон;
5. Вкажіть елемент, якому відповідає електронна формула 1S22S2P63S1:
а) Кальцію; б) Натрію; в) Фосфору; г) Магнію.
6. Вкажіть пари хімічних елементів, які мають найбільш подібні властивості:
а) Сa та Na; б) Al та C; в) Br та Cl; г) Mg та Cl.
7. Вкажіть порядкові номера елементів, у яких на зовнішньому рівні 4 електрони:
а) 11; б) 22; в) 32; г) 30.
8. Можливі ступені окиснення Сульфуру
а)-4 - +5; б) -2 - +6; в) -4 - +4.
9. Чи правильним є твердження: У ядрі містяться протони і електрони.
а) так; б) ні.
10. Одна із р-орбіталей зобрадена намалюнку:
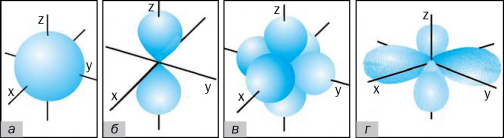
11. Установіть відповідність між електронною формулою елемента й номером періоду, в якому він стоїть.
|
1) I |
а) 1S22S1 |
|
2) II |
б) 1S22S22 p63s23 p64s2 |
|
3) III |
в) 1s1 |
|
4) IV |
г) 1s22s22 p63s23 p3 |
12. Встановіть взаємозв’язок між назвою елементу, зарядом атомного ядра та числом енергетичних рівнів
|
Назва елементу |
Заряд ядра атома |
Число енергетичних рівнів |
|
1. Натрій |
А +8 |
п’ять |
|
2. Цинк |
Б +11 |
два |
|
3. Оксиген |
В +53 |
три |
|
4. Йод |
Г +30 |
чотири |


про публікацію авторської розробки
Додати розробку
