Урок фізики 8 клас. Електричний струм у рідинах. Застосування електролізу
 Тема: Електричний струм у рідинах. Застосування електролізу
Тема: Електричний струм у рідинах. Застосування електролізу
Мета: - Вивчити природу електричного струсу в розчинах та розплавах
електролітів, розкрити механізм електролітичної дисоціації та
процесу електролізу.
- розвивати вміння застосовувати теоретичні знання для пояснення та розв’язання практичних завдань, поглиблювати меж предметні зв’язки;
- виховувати зацікавленість до предмету, вміння відстоювати власну думку.
Обладнання: джерело постійного струму до 24 В, демонстраційний амперметр, вольтметр, гальванометр, низьковольтна лампа, комплект приладів для електролізу, розчин NaCl, CuSO4, кристалики перманганату калію KMnO4, алюмінієва посудина від калориметра, з’єднувальні провідники, дистильована вода, таблиця розчинності кислот, лугів, солей, таблиця «Ряд електрохімічних напруг металів» .
Хід уроку
І. Організаційний момент.
Вступне слово вчителя.
Ми вже розглянули основні закономірності й особливості існування електричного струму в металах, напівпровідниках, вакуумі. Встановили залежності сили струму від напруги для названих середовищ, з’ясували, як залежить опір від температури, геометричних параметрів провідника тощо.
А тепер розглянемо, як протікає струм у рідинах – розчинах або розплавах. Дамо відповіді на запитання: які умови існування струму в них ? Які процеси і чому відбуваються, чи усі розчини (рідини) здатні проводити електричний струм?
П. Актуалізація знань.
Учні відповідають на запитання пояснюють, аргументують свої відповіді, доповнюють товаришів.(На екрані слайд з запитаннями)
-
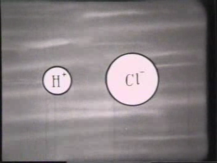 Що станеться з кристаликом кухонної солі, якщо його кинути у воду? (Розчиниться у воді).
Що станеться з кристаликом кухонної солі, якщо його кинути у воду? (Розчиниться у воді).
-
 Які саме частинки будуть у розчині? (іони натрію і хлору)
Які саме частинки будуть у розчині? (іони натрію і хлору)
- Наведіть приклади речовин, молекули яких у воді розпадаються на іони.( для перевірки правильності відповідей звіряємося з таблицею розчинності кислот, лугів, солей.)
- Пригадайте, як на уроках хімії ви називали розчини кислот, лугів, розчинних солей? ( електролітами)
- Чи будуть електролітами водні розчини таких речовин як цукор, крейда? Чому?( ні , бо не розчинні у воді)
-
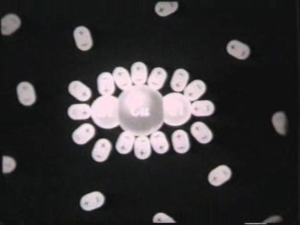 Як називають процес розпаду молекул речовини на іони? (дисоціацією, точніше – електролітичною дисоціацією
Як називають процес розпаду молекул речовини на іони? (дисоціацією, точніше – електролітичною дисоціацією
ІІІ. Вивчення нового матеріалу.
- Розповідь учителя.
Іони мають заряд. Вони в розчині можуть вільно рухатися, тому електроліти мають бути добрими провідниками струму.
Демонстрація відео фрагменту «Електроліз»
Дослід 1. Відсутність електричного струму в електричному колі при зануренні електродів в дистильовану воду.
Давайте на досліді переконаємося в цьому. Складемо електричне коло із джерела струму, низьковольтної лампи, приладу для електролізу (з мідними електродами), з’єднаних послідовно.

 Електроди зануримо у склянку з дистильованою водою(або водою з талого снігу). Збільшуємо напругу до10 – 12 В і спостерігаємо, що лампа не світиться – струму немає. Не змінюючи напруги, невеликими порціями до води доливаємо розчин кухонної солі.
Електроди зануримо у склянку з дистильованою водою(або водою з талого снігу). Збільшуємо напругу до10 – 12 В і спостерігаємо, що лампа не світиться – струму немає. Не змінюючи напруги, невеликими порціями до води доливаємо розчин кухонної солі.
Помічаємо, що лампа починає світитися, яскравість збільшується. Отже, в розчині є заряджені частинки, рух яких і створює струм.
- То які частинки є носіями струму в електролітах? (Позитивні і негативні іони)
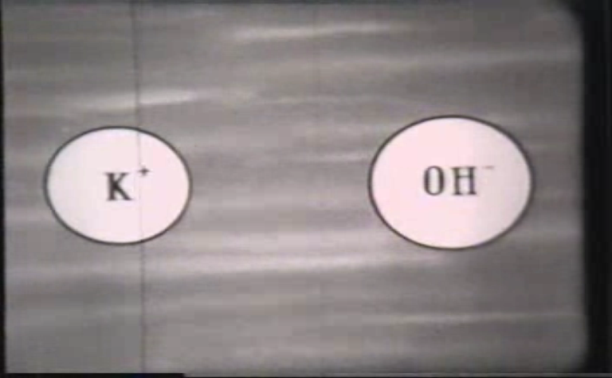
Запишіть тему уроку. ( на екрані слайд з темою, метою уроку)
Розпад молекул на іони може відбуватися не лише при розчиненні, а й при плавленні речовин: під дією високої температури під час плавлення молекули також розпадаються на іони. Тобто розплави солей, основ – також електроліти ! Але, як ми з’ясували, не всі молекули у воді розщеплюються на іони.
Спробуйте з’ясувати механізм розривання молекули на іони.
2. Робота з підручником. § 88, с. 260 (2-й абзац) учні самостійно опрацьовують матеріал за підручником Гончаренко С.У.
Дайте відповіді на запитання (на екрані слайд із запитаннями)
- Яка саме властивість молекул розчинника є вирішальною при розриві зв’язків у молекулах, що дисоціюють?(Молекули води є полярними. Навколо них виникає досить сильне електричне поле, яке, діючи на іони молекули розчинюваної речовини, послаблює зв’язок між ними.)
- У скільки приблизно разів послаблюється взаємодія між іонами? (Наближено можна вважати в ε раз. Для води ε = 81)
- Чи розпадуться на іони молекули NaCl? Наприклад, у гасі? Ε гасу 2,1. (Ні. Тому що, судячи зі значення ε, молекули гасу не є полярними і недостатньо послабляють зв’язок між іонами натрію і хлору).

3. Міжпредметні зв’язки.
Отже, з вивченого на уроці та з матеріалу, який ви вже знаєте з курсу хімії,
Приходимо до висновку: (слайд на екрані)
-
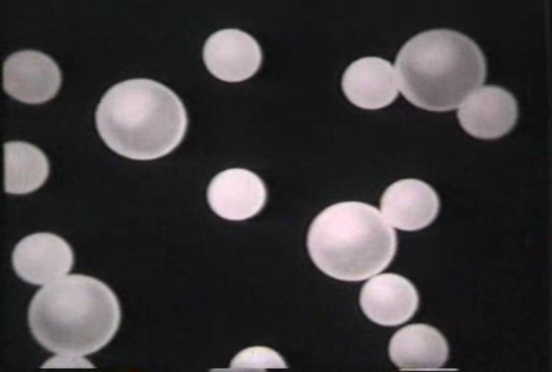 Процеси розпаду молекул з іони – дисоціації, та утворення молекул з іонів – рекомбінації – оборотні. І за незмінних інших умов (температури, концентрації, взаємодії з іншими речовинами) встановлюється динамічна рівновага.
Процеси розпаду молекул з іони – дисоціації, та утворення молекул з іонів – рекомбінації – оборотні. І за незмінних інших умов (температури, концентрації, взаємодії з іншими речовинами) встановлюється динамічна рівновага.
- Не всі молекули речовини дисоціюють. Тому вводять поняття ступеня електролітичної дисоціації. Це число, яке дорівнює відношенню кількості молекул, що розпалися на іони, до загальної кількості молекул у розчині:
Α = Nрозп / N заг
Демонстрація відео фрагменту «Електроліз»
- Створення проблемної ситуації.
( учні відповідають на запитання, відповіді записуються на дошці, потім перевіряються дослідним шляхом )
- Як ви вважаєте, чи залежить електрична провідність електроліту від ступеня дисоціації? ( так, чим більший ступінь дисоціації, тим краща провідність електроліту)
- Молекули електроліту в розчині розпадаються на іони – заряджені частинки. То чи матиме заряд електроліт?( ні, бо сумарний заряд усіх іонів дорівнює нулю)
 - Але якщо в розчин електроліту занурити електроди, до яких прикладемо напругу, то в розчині виникне струм: позитивні іони рухаються до негативного катода, а негативні – до анода.
- Але якщо в розчин електроліту занурити електроди, до яких прикладемо напругу, то в розчині виникне струм: позитивні іони рухаються до негативного катода, а негативні – до анода.
Чи залежатиме величина струму від прикладеної напруги?( напевне так, чим більша напруга, тим більшою має бути сила струму, тому що зі збільшенням напруженості електричного поля на іони діятиме більша сила, що спонукає їх рухатися)
Перевіримо правильність відповідей та залежність між силою струму при електролізі від прикладеної напруги, тобто одержимо Вольт-амперну характеристику (ВАХ).

Дослід 2. ( 2 учні викликаються до дошки, як помічники. Один допомагає збирати електричне коло, інший зображає схему кола на дошці, решта учнів виконують записи у зошитах та слідкують за ходом експерименту)
У ролі електроліту беремо розчин мідного купоросу, в який занурюємо мідні електроди. Спостерігаємо за показами амперметра та вольтметра, дані заносимо у таблицю, будуємо графік ВАХ.
 ТАБЛИЦЯ (заповнюють учні)
ТАБЛИЦЯ (заповнюють учні)
|
U, (В) |
0 |
4 |
8 |
12 |
1 6 |
20 |
|
I, (А) |
0 |
|
|
|
|
|
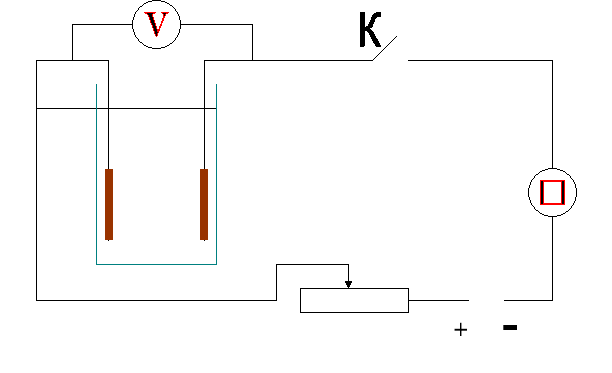
Послідовно збільшуючи напругу з інтервалом 3-4 В, фіксуються відповідні значення сили струму. За одержаними значеннями будують графік залежності І (U).
Звертається увага учнів на пропорційність залежності, на точність дотримання масштабу.
Учитель: При побудові графіку ви помітили, що він зміщений вправо, і не проходить через початок координат.
Пояснення вчителя.
Причиною зміщення графіка вправо є виникнення ЕРС поляризації, яка направлена проти ЕРС джерела. І коли зовнішня (прикладена) напруга досягне значення ЕРС поляризації U = Uп, виникне струм. А далі, як видно з графіка, зміна сили струму відбувається за законом Ома:

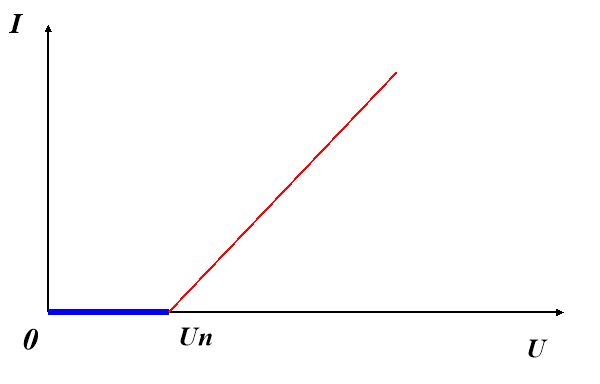
Таким чином, при U > Uп :
І = U – Uп / R
Де R – опір електроліту.
- Пригадайте, для струму в яких середовищах ВАХ не є прямо пропорційною залежністю? Для яких середовищ закон Ома не справджується? (напівпровідники, вакуум).
На екрані демонструється графік для перевірки вірності побудови.
Завдання учням: обчисліть значення опору за даними експерименту. Для довільної пари значень ∆U та ∆І. R= ∆U / ∆І
5.Розповідь учителя з елементами співбесіди. Давайте разом спробуємо встановити, від яких факторів може залежати опір електроліту.
Опір електролітів залежить від:
а) концентрація розчину;
б) природа самого розчину;
в) геометричні розміри та форма електродів;
г) температура.
Учитель: з підвищенням температури опір електролітів зменшується з двох причин : зі збільшенням температури зростає ступінь дисоціації, отже, зростає концентрація іонів, крім того, зростає швидкість руху іонів, тобто їх рухливість.
 Завдання учням: - порівняйте залежність опору від температури ( у металів з підвищенням температури опір зростає, а в електролітів – зменшується);
Завдання учням: - порівняйте залежність опору від температури ( у металів з підвищенням температури опір зростає, а в електролітів – зменшується);
- зверніть увагу на катод, з яким ми проводили дослід – на ньому з розчину CuSO4 виділилася мідь. Як пояснити цей факт? ( так як позитивні іони міді рухаються до катода, то одержавши від нього заряд 2е-, перетворюються в нейтральні атоми міді.)
- Який процес відбувся з точки зору хімії? ( відновлення іонів міді
![]() Cu2+ + 2е- Cu0)
Cu2+ + 2е- Cu0)
Демонстрація відео фрагменту «Вана з електродами»

Учитель: Отже, на катоді при електролізі виділяється речовина (за рахунок реакції відновлення). Саме таким чином одержують різні метали: алюміній, мідь, лужні метали. Але це ми детальніше розглянемо пізніше
.
- Повідомлення учнів. Застосування електролізу.
Демонстрація відео фрагментів «Застосування електролізу.»







IV. Закріплення вивченого.
«Марафон» :
- Електроліт - це…
- Який процес називають електролітичною дисоціацією?
- Явище рекомбінації – це…
- Чому електроліт залишається електро нейтральним?
-
 Яка природа електричного струму в електролітах?
Яка природа електричного струму в електролітах?
- Чим відрізняється механізм провідності електролітів?
- Від чого залежить опір електроліту?
- Ступінь електролітичної дисоціації визначається…
V. Підведення підсумків.
VІ. Домашнє завдання. §.


про публікацію авторської розробки
Додати розробку
