Урок на тему "Історія вивчення атома"
Тема: Атомна та ядерна фізика
Тема уроку: Історія вивчення атома. Ядерна модель атома. Квантові постулати Н. Бора.
Мета уроку: дати учням уявлення про будову атома; познайомити їх із планетарною моделлю атома Резерфорда; розглянути сучасні теорії будови атомного ядра;
розвивати уяву, творче мислення;
виховувати працелюбність та наполегливість.
Тип уроку: набуття нових знань
Методи навчання: евристична бесіда; демонстрація
Обладнання: комп’ютер, мульти-медіа
Хід уроку.
І. Організаційний момент.
ІІ. Актуалізація опорних знань.
Фронтальне опитування:
1. З чого складаються всі тіла?
2. Що ви знаєте про атом?
ІІІ. Повідомлення теми, мети й завдань уроку.
Тема уроку: Історія вивчення атома. Ядерна модель атома. Квантові постулати Н. Бора.
Мета уроку: дати учням уявлення про будову атома; познайомити їх із планетарною моделлю атома Резерфорда; розглянути сучасні теорії будови атомного ядра;
ІV. Мотивація навчальної діяльності
Відкриття складної будови атома - найважливіший етап становлення сучасної фізики, який позначився на ньому її наступному розвитку. У процесі створення теорії будови атома, яка пояснила атомні спектри, відкрито нові закони руху мікрочастинок - закони квантової механіки.
V. Сприйняття й первинне осмислення нового матеріалу
План вивчення теми:
1. Історія уявлень про будову атомного ядра.
2. Будова атома Томсона.
3. Будова атома Резерфорда.
4. Розщеплення ядра. Протон.
5. Квантові постулати Н.Бора.
6. Сучасні теорії будови атомного ядра
1. Історія розвитку уявлень про будову атомного ядра.
Усі тіла навколишньої живої й неживої природи складаються з дрібних частинок — атомів: Першими, хто висловив припущення про це, вважаються давньогрецькі філософи Левкіпп і Демокріт. Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Ні природу, ні механізм утворення цих зв'язків вони не уточнювали, зате зробили припущення про форму атомів. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»).
Більше двадцяти століть знадобилося вченим для того, щоб експериментально підтвердити атомістичну теорію будови речовини. Остаточно ця ідея утвердилася в науці в другій половині дев'ятнадцятого століття. До початку двадцятого століття фізики вже мали досить інформації про масу й розміри атома. На той час стало зрозумілим, що атоми не є дрібними частинками в складі речовини. Вони мають певну внутрішню структуру, розгадка якої дозволила б пояснити періодичність властивостей хімічних елементів. Однак тільки експерименти англійського фізика Ернеста Резерфорда стали основою для створення сучасної протонно-нейтронної моделі атома.
2. Модель атома Томсона
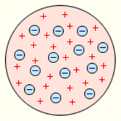 У 1903 році англійський фізик Джозеф Джон Томсон запропонував модель атома у вигляді позитивно зарядженої по всьому об'єму сфери діаметром 10~10 м, усередину якої, ніби родзинки в пудинг, вкраплені електрони.
У 1903 році англійський фізик Джозеф Джон Томсон запропонував модель атома у вигляді позитивно зарядженої по всьому об'єму сфери діаметром 10~10 м, усередину якої, ніби родзинки в пудинг, вкраплені електрони.
Позитивний заряд сфери компенсується сумарним негативним зарядом електронів. Випромінювання світла відбувається в результаті коливання атомів відносно центру сфери.
Томсон розташував електрон в атомі Гідрогену в центрі позитивно зарядженої сфери. У багатоелектронних атомах електрони формували в стійкі конфігурації, параметри яких можна було розрахувати. Томсон вважав, що саме конфігурація електронів визначає хімічні властивості атомів. Пізніше ідея Томсона розділити електрони в атомі на групи призвела до появи теорії атомних орбіталей. Однак пізніші відкриття змусили відмовитися від теорії Томсона на користь планетарної моделі атома.
3. Модель атома Резерфорда
Нову модель будови атома Резерфорд запропонував 1911 року, як висновок із експеримету з розсіяння альфа-частинок на золотій фользі, проведеного під його керівництвом. При цьому розсіянні несподівано велика кількість альфа-частинок розсіювалася на великі кути, що свідчило про те, що центр розсіяння має невеликі розміри й в ньому зосереджений значний електричний заряд.
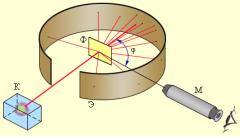 Розрахунки Резерфорда показали, що розсіювальний центр, заряджений додатньо або від'ємно, повинен бути принаймні у 3000 разів менший від розміру атома, який на той час уже був відомий і оцінювався як, приблизно, 10-10 м.
Розрахунки Резерфорда показали, що розсіювальний центр, заряджений додатньо або від'ємно, повинен бути принаймні у 3000 разів менший від розміру атома, який на той час уже був відомий і оцінювався як, приблизно, 10-10 м. ![]()
Ядерна модель атома Резерфорда («Планетарна модель атома»):
 1. атоми будь-якого елемента складаються з позитивно зарядженої частинки, що дістала назву ядра;
1. атоми будь-якого елемента складаються з позитивно зарядженої частинки, що дістала назву ядра;
2. до складу ядра входять позитивно заряджені елементарні частинки – протони (пізніше було встановлено, що й нейтральні нейтрони);
3. навколо ядра рухаються електрони, що утворюють так звану електронну оболонку.
Оскільки на той час електрони вже були відомі, а їхня маса й заряд визначені, то розсіювальний центр, який пізніше назвали ядром, повинен був мати протилежний до електронів заряд. Резерфорд не пов'язав величину заряду з атомним номером. Цей висновок був зроблений пізніше. А сам Резерфорд припустив, що заряд пропорційний атомній масі.
Недоліком планетарної моделі була її несумісність із законами класичної фізики. Якщо електрони рухаються навколо ядра як планети навколо Сонця, то їхній рух прискорений, і, отже, за законами класичної електродинаміки вони повинні були б випромінювати електромагнітні хвилі, втрачати енергію й падати на ядро.
Наступним кроком у розвитку планетарної моделі стала модель Бора, що постулювала інші, відмінні від класичних, закони руху електронів. Повністю протиріччя з електродинамікою змогла розв'язати квантова механіка.
Планетарна модель атома багато пояснила в будові атома, але одразу після її створення виникли труднощі: ядро заряджене позитивно, а електрони - негативно. Між ними існує кулонівська сила притягання. Для того, щоб електрони не впали на ядро, вони мусять рухатись навколо нього з доцентровим прискоренням. З теорії Максвелла випливає, що якщо заряд рухається з прискоренням, то при цьому має випромінюватись електромагнітна хвиля, а розрахунки показують, що за час ![]() t = 10
t = 10![]() c електрон, рухаючись по спіралі мусить припинити свій рух.
c електрон, рухаючись по спіралі мусить припинити свій рух.
Дослідні ж дані показували, що за нормальних умов атом не випромінює енергію і існує як завгодно довго.
Вихід із ситуації 1913 року запропонував датський фізик Нільс Бор.
Він створив теорію атома на основі таких постулатів:
- Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія En. У стаціонарному стані атом енергію не випромінює.
-
Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких h
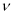 визначають за формулою
визначають за формулою 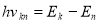 , де k і n – номери його стаціонарних станів. При
, де k і n – номери його стаціонарних станів. При 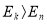 відбувається випромінювання фотона, а при
відбувається випромінювання фотона, а при 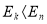 - його поглинання.
- його поглинання.
Модель атома Бора.
Перейнявшись ідеями Резерфорда, Бор на основі планетарної моделі розвиває теорію будови атома, яка згодом була названа моделлю Резерфорда — Бора.
Справа в тому, що класична модель Резерфорда не могла пояснити деякі явища в атомі. Так, залишалася незрозумілою стійкість атома. Теоретично, рухаючи по своїх орбітах із великим прискоренням, електрон повинен випромінювати електромагнітні хвилі, що супроводжується втратою енергії. Втрачаючи енергію, електрон повинен наближатися до ядра і дуже скоро упасти на нього. Крім того, не вдавалося пояснити походження спектрів атомів, що складаються з певних ліній. Якщо характер руху електрона пояснювати законами електродинаміки, то спектр атома повинен бути суцільний, тоді як експериментально були отримані лінійчаті спектри. Лінії у них групуються в серії і згущаються в короткохвильовій частині спектра. Передбачалося, що частоти ліній відповідних серій підкоряються певним математичним законам.
«Основним результатом ретельного аналізу видимої серії лінійчатих спектрів і їхніх відношень, — писав Бор, — було встановлення того факту, що частота v кожної лінії спектра цього елемента може бути представлена з незвичайною точністю формулою v = Тr — Тrr, де Тr і Тrr — якісь два члени з безлічі спектральних елементів T, що характеризують елемент».
Бору вдалося знайти пояснення цього основного закону спектроскопії. Але для цього йому довелося ввести поняття стаціонарних орбіт або станів атомів, у яких електрон рухається по орбіті, не випромінюючи при цьому енергії.
Ця ідея зараз широко відома під назвою першого постулату Бора. Він суперечить і класичній механіці, і електродинаміці Максвелла. По-перше, він чітко визначає енергію електронів у кожному стаціонарному стані, а по-друге, допускає можливість прискореного руху без випромінювання електромагнітних хвиль.
Другий постулат Бора .також суперечить електродинаміці Максвелла, пов'язуючи частоту випромінювання винятково зі зміною енергії атома, а не з частотою обертання електрона по орбіті. Однак ці постулати підтверджуються квантово-механічними розрахунками. Тому на сьогоднішній день модель атома Бора є головною відправною точкою для розробки єдиної послідовної теорії атомного ядра.
4. Розщеплення ядра. Протон.
У 1919 році Резерфорд зробив чергове сенсаційне відкриття. Йому вдалося розщепити ядро.
Вивчаючи зіткнення а-частинок із легкими атомами, Резерфорд встановив, що при ударі а-частинки об ядро Гідрогену воно збільшує свою швидкість у 1,6 разу й відбирає 64 % енергії а-частинки. У результаті зіткнень атомів Нітрогену з а-частинками виходять частинки з максимальним пробігом, що відповідає пробігу атомів Гідрогену.
«З отриманих досі результатів, — писав Резерфорд, — важко уникнути висновку, що атоми з великим пробігом, які виникають при зіткненні а-частинок з Нітрогеном, є не атомами Нітрогену, але, цілком ймовірно, атомами Гідрогену або атомами з масою 2. Якщо це так, то ми повинні визнати, що атом Нітрогену розпадається унаслідок величезних сил, які розвиваються при зіткненні зі швидкою α-частинкою, і що атом Гідрогену, який звільняється, утворює складову частину атома».
Так була уперше висловлена думка про те, що ядра Гідрогену є основною частиною ядер атомів. Пізніше для позначення ядер Гідрогену був запропонований термін «протон».
Великим кроком до встановлення будови атома стала гіпотеза Марії Склодовської-Кюрі про те, що до складу ядра входять електрони. Спираючись на неї, Резерфорд припустив, що в природі існують ядра з масою одного, двох і трьох ядер Гідрогену, але з нульовим зарядом.
Резерфорд писав, що йому «здається досить правдоподібним, що один електрон може зв'язати два Н-ядра і, можливо, навіть і одне Н-ядро. Якщо справедливим є перше припущення, то воно вказує на можливість існування атома з масою близько 2 і з одним зарядом. Таку речовину потрібно розглядати як ізотоп Гідрогену. Друге припущення містить у собі думка про можливості існування атома з масою 1 і нуклеарним зарядом, що дорівнює нулю. Подібні утворення видаються цілком можливими». Так була висловлена гіпотеза про існування нейтрона і важкого ізотопу Гідрогену.
5. Квантові постулати Бора.
На початку XX століття серед довжелезної низки нерозв’язаних проблем фізики атома однією з найбільш гострих було пояснення оптичних спектрів атома. Теорія атома мала визначити положення кожної спектральної лінії в спектрах усіх елементів.
У 1885 році швейцарський фізик І. Бальмер довів, що всі частоти видимої частини спектра випромінювання атома Гідрогену можуть бути обчислені за дуже простою формулою (серія Бальмера):
![]() , де R – величина стала, а m = 3,4,5,…, ∞.
, де R – величина стала, а m = 3,4,5,…, ∞.
Пізніше, 1906 року, англійським фізиком Лайманом була відкрита серія ліній в ультрафіолетовій частині спектра Гідрогену (серія Лаймана):
![]() .
.
У 1908 році німецьким фізиком Пашеном була відкрита серія ліній в інфрачервоній частині спектра Гідрогену (серія Пашена):
![]() .
.
Отже, частоту будь-якої лінії в спектрі атома Гідрогену можна подати у вигляді:
![]()
Із цієї формули видно, що в спектральних закономірностях особливо важливу роль відіграють цілі числа m і n, так звані головні квантові числа.
Усі наведені вище формули є чисто емпіричними. Пояснити лінійчастий спектр випромінювання атомів Гідрогену вдалося лише після створення Н. Бором квантової теорії будови атома Гідрогену.
У 1913 року датський фізик Нільс Бор запропонував основні положення квантової теорії у вигляді постулатів-тверджень, прийнятих за вихідні положення. Причому і закони класичної фізики ним повністю не відкидалися. Нові постулати швидше накладали лише певні обмеження на рухи, які допускає класична механіка.
І все ж успіх теорії Бора був вражаючим. Усім вченим стало зрозуміло, що Бор знайшов правильний шлях розвитку теорії, який привів згодом до створення стрункої теорії руху мікрочастинок – квантової механіки.
Нільс Бор створив теорію атома на основі таких постулатів:
1. Атомна система може перебувати тільки в особливих стаціонарних, або квантових станах, кожному з яких відповідає певна енергія E![]() . У стаціонарному стані атом енергію не випромінює.
. У стаціонарному стані атом енергію не випромінює.
2. Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких h![]() визначають за формулою
визначають за формулою ![]() , де k і n – номери його стаціонарних станів. При
, де k і n – номери його стаціонарних станів. При ![]() відбувається випромінювання фотона, а при
відбувається випромінювання фотона, а при ![]() - його поглинання.
- його поглинання.
3. У стаціонарному стані атома електрон, рухаючись по коловій орбіті, повинен мати дискретні, квантові значення моменту імпульсу ![]() , де n – 1,2,3 – номер орбіти; r – радіус орбіти;
, де n – 1,2,3 – номер орбіти; r – радіус орбіти; ![]()
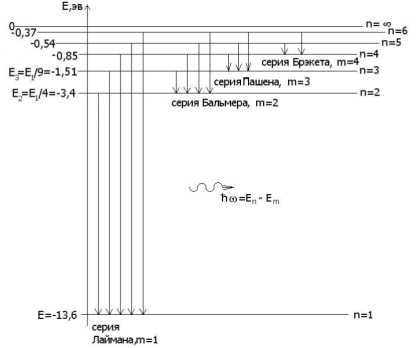
Енергетичні рівні атома Гідрогену
Перший постулат називається постулатом стаціонарних станів. Цей постулат суперечить класичній механіці та електродинаміці Максвелла.
Другий постулат називається правилом частот. Якщо електрон перескакує на іншу орбіту, де його енергія менша, то куди дівається надлишок енергії? Адже зникнути, перетворитися на ніщо енергія не може. «Шукайте її поза атомом!» - заявляє Бор. Вона виділяється з атома у вигляді кванта світлової енергії, а електрон, який випроменив, рухається по орбіті, тепер вже іншій, і знову не випромінює.
Третій постулат називається правилом квантування орбіт. Виявилося, що можна одержати низку дискретних розділених стаціонарних станів тільки за того припущення, що момент імпульсу електрона кантується. Звідси дістаємо вираз для радіусів орбіт: ![]() , де m
, де m![]() й e – маса та заряд електрона.
й e – маса та заряд електрона.
Фізики до появи теорії бора не могли розшифрувати складні спектри. Коли ж Бор довів, що «спектр – це біографія атомів, точніше атомних електронів», учені змогли, комбінуючи різні орбіти електронів в атомі, обчислити всі лінії, що спостерігаються у спектрі. Таким чином, джерелом світла є збуджений атом, світло генерується під час переходу атома з одного збудженого стану в інший, частота світла, що генерується, пропорційна ∆Е, світло випромінюється й поглинається у вигляді квантів.
6. Сучасні теорії будови атомного ядра.
Краплинна модель ядра
Краплинна модель ядра була запропонована в 1936 році Бором і Френкелем. Вона ґрунтувалася на аналогії між поведінкою нуклонів у ядрі та поведінкою молекул у краплі рідини. В обох випадках сили, що діють між складовими частинками рідини (молекулами) і ядра (нуклонами), є короткодіючими, і їм властиве насичення. Для краплі рідини при постійних зовнішніх умовах характерною є постійна густина речовини. Ядра ж характеризуються практично постійною питомою енергією зв'язку і постійною густиною, що не залежить від числа нуклонів у ядрі. Нарешті, розмір краплі, як і розмір ядра, пропорційний до числа частинок. Однак ця модель представляє ядро як краплю електрично зарядженої нестисливої рідини з густиною, що дорівнює ядерній. Ця рідина підпорядковується законам квантової механіки. Краплинна модель ядра дозволила одержати напівемпіричну формулу для енергій зв'язку нуклонів у ядрі, пояснила механізм ядерних реакцій і особливо добре описала реакції розподілу ядра. Однак вона не пояснює підвищену стійкість ядер, що містять магічні числа протонів і нейтронів.
Оболонкова модель ядра.
У 50-х роках двадцятого століття американець М. Гепперт-Майер і німець X. Йенсен виступили з оболонковою моделлю ядра. Відповідно до неї розподіл нуклонів у ядрі відбувається за дискретними енергетичними рівнями (оболонками), що заповнюються нуклонами відповідно до принципу Паулі. До того ж вона пов'язала заповнення цих рівнів зі стійкістю ядер. Вважається, що ядра з повністю заповненими оболонками є найбільш стійкими. Такі особливо стійкі (магічні) ядра справді існують. Це ядра, в яких число протонів або число нейтронів дорівнює одному з магічних чисел (2, 8, 20, 28, 50, 82, 126).
Оболонкова модель ядра дозволила пояснити спіни і магнітні моменти ядер, різну стійкість атомних ядер, а також періодичність змін їхніх властивостей. Ця модель особливо добре описує легкі й середні ядра, а також ядра в основному (незбудженому) стані.
У міру подальшого нагромадження експериментальних даних про властивості атомних ядер з'являлися нові факти, які не завжди вкладалися в рамки описаних моделей. Так виникли узагальнена модель ядра (синтез краплинної й оболонкової моделей), оптична модель ядра (пояснює взаємодію ядер із частинками, що налітають) і багато інших.
VI. Закріплення нового матеріалу
1. Як називається модель атома Томсона?
2. Чому модель атома Томсона була спростована?
3. Яку назво отримала модель атома Резерфорда?
4. які недоліки має модель атома Резерфорда?
VІІ. Про що ми дізнались на уроці
1903 році англійський фізик Джозеф Джон Томсон запропонував модель атома у вигляді позитивно зарядженої по всьому об'єму сфери діаметром 10~10 м, усередину якої, ніби родзинки в пудинг, вкраплені електрони.
Ядерна модель атома Резерфорда («Планетарна модель атома»):
1. атоми будь-якого елемента складаються з позитивно зарядженої частинки, що дістала назву ядра;
2. до складу ядра входять позитивно заряджені елементарні частинки – протони (пізніше було встановлено, що й нейтральні нейтрони);
3. навколо ядра рухаються електрони, що утворюють так звану електронну оболонку.
VІІІ. Підбиття підсумків уроку
Мотивоване оцінювання учнів.
VІІІ.Домашнє завдання: підручник Сиротюк В.Д. фізика 11 клас § 43-44
1


про публікацію авторської розробки
Додати розробку
