Урок "Взаємодія між нуклонами в ядрі, стійкість атомних ядер. Енергія зв’язку атомного ядра. Дефект мас"
Тема уроку: Взаємодія між нуклонами в ядрі, стійкість атомних ядер. Енергія зв’язку атомного ядра. Дефект мас.
Мета уроку: дати учням уявлення про будову атомного ядра; розглянути сучасні теорії будови атомного ядра; дати уявлення про ядерні сили та енергію зв’язку атомних ядер; розвивати уяву, творче мислення; виховувати працелюбність та наполегливість.
Хід уроку.
І. Організаційний момент.
Оголошення теми і мети уроку.
ІІ. Актуалізація опорних знань.
Відкриття складної будови атома - найважливіший етап становлення сучасної фізики, який позначився на ньому її наступному розвитку. У процесі створення теорії будови атома, яка пояснила атомні спектри, відкрито нові закони руху мікрочастинок - закони квантової механіки.
Запитання до класу:
1.В чому полягали досліди Резерфорда?
2. Яку модель будови атома запропонував Резерфорд? Чим вона відрізнялась від моделі Томсона?
3. Сформулюйте квантові постулати Бора.
4. Із хімії, що ви знаєте про будову атома?
Відповіді написати!
Історія розвитку уявлень про будову атомного ядра.
Усі тіла навколишньої живої й неживої природи складаються з дрібних частинок— атомів: Першими, хто висловив припущення про це, вважаються давньогрецькі філософи Левкіпп і Демокріт. Саме вони назвали атомом дрібну неподільну частинку, що утворює речовину. Вони вважали, що речовини утворюються в результаті зіткнення атомів і появи зв'язків між ними. Ні природу, ні механізм утворення цих зв'язків вони не уточнювали, зате зробили припущення про форму атомів. Вони вважали, що атоми мають форму правильних багатогранників: куба («атоми землі»), тетраедра («атоми вогню»), октаедра («атоми повітря»), ікосаедра («атоми води»).
Більше двадцяти століть знадобилося вченим для того, щоб експериментально підтвердити атомістичну теорію будови речовини. Остаточно ця ідея утвердилася в науці в другій половині дев'ятнадцятого століття. До початку двадцятого століття фізики вже мали досить інформації про масу й розміри атома. На той час стало зрозумілим, що атоми не є дрібними частинками в складі речовини. Вони мають певну внутрішню структуру, розгадка якої дозволила б пояснити періодичність властивостей хімічних елементів. Однак тільки експерименти англійського фізика Ернеста Резерфорда стали основою для створення сучасної протонно-нейтронної моделі атома.
ІІІ. Пояснення нового матеріалу.
1. Розщеплення ядра. Протон.
У 1919 році Резерфорд зробив чергове сенсаційне відкриття. Йому вдалося розщепити ядро.
Вивчаючи зіткнення а-частинок із легкими атомами, Резерфорд встановив, що при ударі а-частинки об ядро Гідрогену воно збільшує свою швидкість у 1,6 разу й відбирає 64 % енергії а-частинки. У результаті зіткнень атомів Нітрогену з а-частинками виходять частинки з максимальним пробігом, що відповідає пробігу атомів Гідрогену.
«З отриманих досі результатів, — писав Резерфорд, — важко уникнути висновку, що атоми з великим пробігом, які виникають при зіткненні а-частинок з Нітрогеном, є не атомами Нітрогену, але, цілком ймовірно, атомами Гідрогену або атомами з масою 2. Якщо це так, то ми повинні визнати, що атом Нітрогену розпадається унаслідок величезних сил, які розвиваються при зіткненні зі швидкою α-частинкою, і що атом Гідрогену, який звільняється, утворює складову частину атома».
Так була уперше висловлена думка про те, що ядра Гідрогену є основною частиною ядер атомів. Пізніше для позначення ядер Гідрогену був запропонований термін «протон».
Великим кроком до встановлення будови атома стала гіпотеза Марії Склодовської-Кюрі про те, що до складу ядра входять електрони. Спираючись на неї, Резерфорд припустив, що в природі існують ядра з масою одного, двох і трьох ядер Гідрогену, але з нульовим зарядом.
Резерфорд писав, що йому «здається досить правдоподібним, що один електрон може зв'язати два Н-ядра і, можливо, навіть і одне Н-ядро. Якщо справедливим є перше припущення, то воно вказує на можливість існування атома з масою близько 2 і з одним зарядом. Таку речовину потрібно розглядати як ізотоп Гідрогену. Друге припущення містить у собі думка про можливості існування атома з масою 1 і нуклеарним зарядом, що дорівнює нулю. Подібні утворення видаються цілком можливими». Так була висловлена гіпотеза про існування нейтрона і важкого ізотопу Гідрогену.
2. Сучасні теорії будови атомного ядра.
Протонно-нейтронна модель ядра.
Сьогодні фізики усього світу користуються теорією про те, що ядро складається з елементарних частинок — протонів і нейтронів. Уперше таке припущення висловив у 1932 році радянський фізик Д. Д. Іваненко. Однак протонно-нейтронна модель ядра не відразу була прийнята ученими. Навіть Резерфорд стверджував, що нейтрон — лише складне утворення протона й електрона. У 1933 році Іваненко виголосив доповідь про моделі ядра, відстоюючи протонно-нейтронну теорію. Він спирався на те, що в ядрі є тільки важкі частинки.
Іваненко відкинув ідеї про складну структуру нейтрона й протона. На його думку, обидві частинки повинні мати однаковий ступінь елементарності, тобто і нейтрон, і протон можуть переходити один в одного. Надалі протон і нейтрон почали розглядатися як два стани однієї частинки — нуклона, й ідея Іваненко стала загальноприйнятою, а незабаром у складі космічних променів була відкрита ще одна елементарна частинка — позитрон.
Зараз протонно-нейтронна модель ядра вже не викликає сумнівів. Крім того, протягом довгого часу існувала гіпотеза про те, що в ядрі можуть знаходитися також і електрони. Однак вона мала дуже багато протиріч і не була підтверджена експериментально. Так, відповідно до цієї гіпотези, масове число повинно відповідати загальній кількості протонів у ядрі, а різниця масового числа й кількості електронів повинна дорівнювати зарядові ядра. Ця модель не суперечила значенням ізотопних мас і зарядів, однак не погоджувалася зі значеннями магнітних моментів ядер, спінів й енергій зв'язку ядра.
Краплинна модель ядра
Краплинна модель ядра була запропонована в 1936 році Бором і Френкелем. Вона ґрунтувалася на аналогії між поведінкою нуклонів у ядрі та поведінкою молекул у краплі рідини. В обох випадках сили, що діють між складовими частинками рідини (молекулами) і ядра (нуклонами), є короткодіючими, і їм властиве насичення. Для краплі рідини при постійних зовнішніх умовах характерною є постійна густина речовини. Ядра ж характеризуються практично постійною питомою енергією зв'язку і постійною густиною, що не залежить від числа нуклонів у ядрі. Нарешті, розмір краплі, як і розмір ядра, пропорційний до числа частинок. Однак ця модель представляє ядро як краплю електрично зарядженої нестисливої рідини з густиною, що дорівнює ядерній. Ця рідина підпорядковується законам квантової механіки. Краплинна модель ядра дозволила одержати напівемпіричну формулу для енергій зв'язку нуклонів у ядрі, пояснила механізм ядерних реакцій і особливо добре описала реакції розподілу ядра. Однак вона не пояснює підвищену стійкість ядер, що містять магічні числа протонів і нейтронів.
Оболонкова модель ядра.
У 50-х роках двадцятого століття американець М. Гепперт-Майер і німець X. Йенсен виступили з оболонковою моделлю ядра. Відповідно до неї розподіл нуклонів у ядрі відбувається за дискретними енергетичними рівнями (оболонками), що заповнюються нуклонами відповідно до принципу Паулі. До того ж вона пов'язала заповнення цих рівнів зі стійкістю ядер. Вважається, що ядра з повністю заповненими оболонками є найбільш стійкими. Такі особливо стійкі (магічні) ядра справді існують. Це ядра, в яких число протонів або число нейтронів дорівнює одному з магічних чисел (2, 8, 20, 28, 50, 82, 126).
Оболонкова модель ядра дозволила пояснити спіни і магнітні моменти ядер, різну стійкість атомних ядер, а також періодичність змін їхніх властивостей. Ця модель особливо добре описує легкі й середні ядра, а також ядра в основному (незбудженому) стані.
У міру подальшого нагромадження експериментальних даних про властивості атомних ядер з'являлися нові факти, які не завжди вкладалися в рамки описаних моделей. Так виникли узагальнена модель ядра (синтез краплинної й оболонкової моделей), оптична модель ядра (пояснює взаємодію ядер із частинками, що налітають) і багато інших.
Український фізик Іваненко і німецький фізик Гейзенберг 1932 року незалежно один від одного запропонували протонно-нейтронну модель ядра, згідно з якою ядро складається із протонів і нейтронів. Оскільки атом в цілому електронейтральний, а заряд протона дорівнює модулю заряду електрона, то число протонів у ядрі дорівнює числу електронів в атомній оболонці. Відповідно число протонів в ядрі дорівнює атомному номеру елемента в періодичній системі елементів Менделєєва. А кількість нейтронів дорівнює різниці між атомною масою ізотопу і значенням порядкового номера.
Суму числа протонів Z і числа нейтронів N називають масовим числом А; воно дорівнює:
A = Z + N.
Маси протонів і нейтронів приблизно однакові і дорівнюють 1 а. о. м. Маса електрона набагато менша від маси ядра. Визначити число протонів і нейтронів в ядрі атома дуже просто. Наприклад:
Визначте число протонів, електронів, нейтронів у атомі хімічного елемента 3 періоду 4 групи головної підгрупи.
Розв'язання.
Шуканий елемент - Si (кремній): протонів 14(порядковий номер), електронів також 14( атом нейтральной), нейтронів знаходиться так: Аr(Si)-к-сть протонів =28-14=14
Усі хімічні елементи, які знаходяться в одній клітинкі таблиці елементів Менделєєва, мають однакові хімічні властивості, але фізичні властивості їх трохи відрізняються. Такі елементи називаються ізотопами. Ізотопи мають ядра атомів з одним і тим самим значенням Z (заряду, а отже однаковою кількістю протонів), але різними кількостями N (кількостями нейтронів). Натепер відомі ізотопи всіх хімічних елементів. Наприклад, водень має три ізотопи:
1. 11Н - водень звичайний - основний ізотоп стабільний.
2. 21Н - дейтерій (тяжкий водень); входить як домішка до природного водню її вміст становить (1/4500 частину).
3. 31Н - надтяжкий водень - тритій; отримують штучним шляхом, β - радіоактивний.
3. Ядерні сили
Між протонами і нейтронами в ядрі діють значні сили кулонівського відштовхування, але ядро не розлітається, оскільки протони і нейтрони в ядрі утримують могутні ядерні сили. Це найпотужніші сили в природі, що є мірою сильної взаємодії. Їх характерна особливість - вони діють на дуже малих відстанях, що приблизно дорівнюють розміру ядра (10-12 – 10-13 см).
Щоб вибити нуклон із ядра, потрібно виконати величезну роботу, тобто передати ядру енергію зв'язку. Це - енергія, яка потрібна для повного розщеплення ядра на нуклони, або енергія, яка виділяється під час утворення ядра із окремих частинок.
Оскільки остаточну теорію ядерних сил поки що не створено, то енергію зв'язку розраховують за формулою Ейнштейна:
E = mc2.
Але точні вимірювання мас ядер показують, що
Mя < Zmp + Nmn,
Існує так званий дефект мас:
ΔM = Zmp + Nmn – Mя.
Підставивши значення дефекту мас в рівняння для енергії, отримаємо формулу для визначення енергії зв'язку:
Eзв = ΔMс2 = ( Zmp + Nmn – Mя)·с2.
Природно, що енергія зв'язку різних ядер може бути різною. Проте якщо віднести її до числа нуклонів, то спостерігається певна залежність питомої енергії зв'язку нуклона в ядрі від масового числа атома А (див. мал.).
Важливу інформацію про властивості ядер містить залежність енергії зв'язку від масового числа А, тобто питома енергія зв'язку.
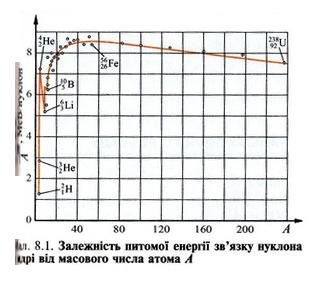
Розглянемо графік такої залежності. Спочатку крива різко зростає і досягає максимуму ![]() в ізотопів елементів з нуклон масовим числом від 50 до 60 (Ферум і близькі до нього елементи).
в ізотопів елементів з нуклон масовим числом від 50 до 60 (Ферум і близькі до нього елементи).
Відношення ![]() називається питомою енергією зв'язку.
називається питомою енергією зв'язку.
У міру подальшого збільшення масового числа атома крива починає плавно спадати, посягаючи значення ![]() в Урану 23892U. Такий вигляд кривої зумовлений закономірностями забудови ядерних оболонок протонами і нейтронами. Проте оболонкова модель ядра неспроможна пояснити характер забудови всіх елементів. Зокрема, вона непридатна для важких елементів, де істотними стають електростатичні сили взаємодії протонів.
в Урану 23892U. Такий вигляд кривої зумовлений закономірностями забудови ядерних оболонок протонами і нейтронами. Проте оболонкова модель ядра неспроможна пояснити характер забудови всіх елементів. Зокрема, вона непридатна для важких елементів, де істотними стають електростатичні сили взаємодії протонів.
ІV. Підсумок уроку.
Запитання до класу:
1. Які відкриття дали поштовх розвитку ядерної фізики?
2. Дайте стислу характеристику протона і нейтрона. Чим вони різняться між собою?
3. Що таке ізотопи?
4. Що таке нуклон? Як визначити число протонів і нейтронів у ядрі атома за допомогою таблиці Менделєєва?
5. Наведіть опис оболонкової моделі ядра атома.
6. У чому полягає суть принципу Паулі?
7. Схарактеризуйте ядерні сили. Які пари нуклонів можуть брати участь у сильній взаємодії?
8. Які види фундаментальних взаємодій виявляються в атомному ядрі? Який внесок кожної з них?
9. Яка природа ядерних сил?
10. Чому виникає дефект мас? Чим це можна пояснити?
11. Яка залежність питомої енергії зв'язку нуклонів у ядрі атома від масового числа в природі?
Відповісти письмово!
V. Домашнє завдання:
1. §38-39 – прочитати, опрацювати матеріал конспекту уроку
2. Записати в зошит:
- Для ядерної фізики характерні відстані, сумірні з розміром ядра (~ 10-15 м), та енергії від мегаелектрон-вольт (МеВ) до гігаелектрон-вольт(ГеВ)
- Протон (від грец. рг>tos — перший) — елементарна частинка, що є ядром атома Гідрогену; має позитивний заряд, що чисельно дорівнює заряду електрона е = 1,602 • 10-19 Кл; його маса значно більша: mр = 1,6726485 • 10-27 кг. Оскільки в ядерній фізиці прийнято користуватися атомною одиницею маси (а.о.м.) та її енергетичним еквівалентом — електрон-вольтом (еВ), маса спокою протона дорівнює mp = 1,007276470 а. о. м., що відповідає 938,2796 МеВ.
- Маса спокою нейтрона mn = = 1,6749543 • 10-27 кг= 1,008665012 а.о.м., що відповідає 939,5731 МеВ.
- Ізотопи (від грец. isos — однаковий і topos — місце) — різновиди одного й того самого хімічного елемента, що відрізняються за атомними масами
- Нейтрон (від лат. пеШгит — ні те, ні інше) — нестабільна електрично нейтральна, тобто така, що не має ні позитивного, ні негативного заряду, елементарна частинка
- У сучасній фізиці протони і нейтрони в ядрі називають нуклонами (від лат. шкіеш — ядро)
- Число нуклонів у ядрі атома дорівнює його масовому числу А. Число протонів у ядрі атома дорівнює заряду ядра 2. Число нейтронів N = А-Z
- Принцип Паулі спочатку був сфор мульований для пояснення зако номірностей у заповненні елект-ронних орбіталей в атомі; згодом він був поширений на всі елемен тарні частинки з напівцілим спіном
- Принцип Паулі є фізичною суттю періодичного закону Д. І. Менделєєва
- Ядерні сили — короткодіючі, оскільки проявляють себе на відстанях у межах атомного ядра (10-15 м)
- Обмінний характер ядерної взаємодії подібний до ковалентного зв'язку між атомами в молекулі, де роль такого «посередника» відіграють валентні електрони
- Наявність ядерних сил зумовлює частинка ненульової маси, якою обмінюються між собою нуклони під час взаємодії. Така частинка була експериментально виявлена і названа пі-мезоном.
- Залежно від типу взаємодіючої пари нуклонів (протон—протон, нейтрон—нейтрон, протон—нейтрон, нейтрон—протон) існує три види пі-мезонів: позитивний (п+), негативний (п-) і нейтральний (п0). Перші два мають масу спокою, яка дорівнює 274 масам електрона те, що відповідає приблизно 140 МеВ; маса спокою третього дорівнює 264 те, що відповідає приблизно 135 МеВ.
- Пі-мезони — це кванти ядерного поля, подібні до фотонів, які є квантами електромагнітного поля
- Пі-мезони інколи називають піонами
- Енергія зв'язку ядра атома — це та мінімальна енергія, яку треба затратити, щоб роз'єднати ядро на окремі нуклони, що входять до його складу
- Точні вимірювання мас атомних ядер показали, що тя < Zтр + Nтп
-
Відношення
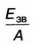 називається питомою енергією зв'язку
називається питомою енергією зв'язку
3. Записати у зошит зразок розв'язку задачі, наданої в конспекті.
4. Відповісти письмово на питання (на оцінку).
Бажаю успіхів!!!


про публікацію авторської розробки
Додати розробку
