Урок з біології Презентація на тему:«БІЛКИ»
План
1)Що таке білки
2)Історія дослідження
3)Будова
 4)Використання людиною Білки — складні високомолекулярні природні органічні речовини, що
4)Використання людиною Білки — складні високомолекулярні природні органічні речовини, що
складаються з амінокислот, сполучених пептидними зв'язками.
• Зазвичай білки є лінійними полімерами — поліпептидами, хоча інколи мають складнішу структуру. Невеликі білкові молекули, тобто олігомери поліпептидів, називаються пептидами. Послідовність амінокислот у конкретному білку визначається відповідним геном і зашифрована генетичним кодом.

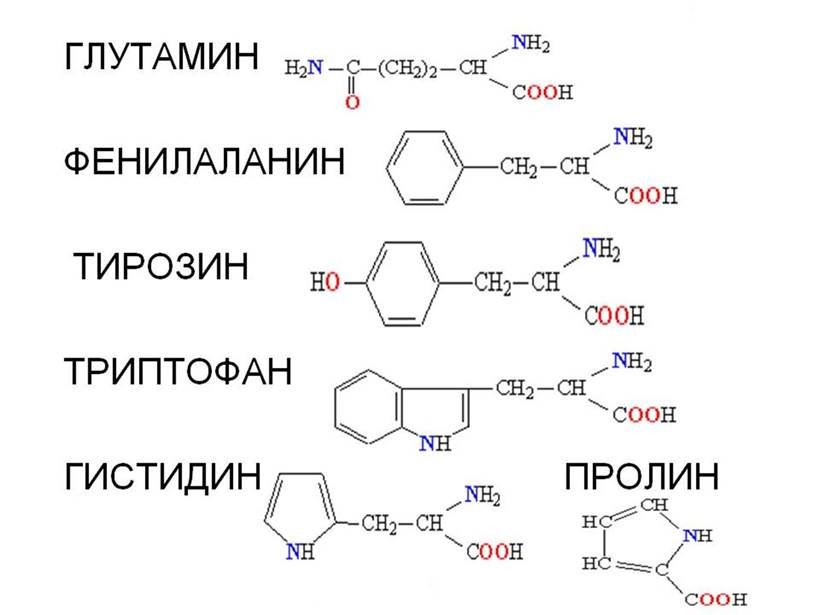
• Функції білків в клітині різноманітніші, ніж функції інших біополімерів — полісахаридів і нуклеїнових кислот. Так, білки-ферменти каталізують протікання біохімічних реакцій і грають важливу роль в обміні речовин. Деякі білки
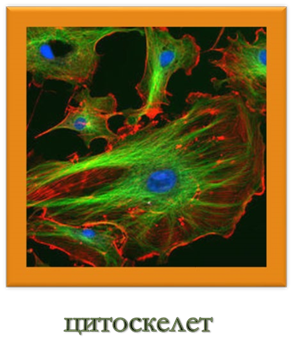 виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин. Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії, імунній відповіді і клітинному циклі.
виконують структурну або механічну функцію, утворюючи цитоскелет, що є важливим засобом підтримки форми клітин. Також білки грають важливу роль в сигнальних системах клітин, клітинній адгезії, імунній відповіді і клітинному циклі.
•  Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.
Білки — важлива частина харчування тварин і людини, оскільки ці організми не можуть синтезувати повний набір амінокислот і повинні отримувати частину з них із білковою їжею. У процесі травлення протелітичні ферменти руйнують спожиті білки, розкладаючи їх до рівня амінокислот, які використовуються при біосинтезі білків організму або піддаються подальшому розпаду для отримання енергії.
•  Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості». Проте, їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком.
Білки були вперше описані шведським хіміком Єнсом Якобом Берцеліусом в 1838 році, який і дав їм назву протеїни, від грец. πρώτα — «першорядної важливості». Проте, їхня центральна роль в життєдіяльності всіх живих організмів була виявлена лише у 1926 році, коли Джеймс Самнер показав, що фермент уреаза також є білком.

Історія дослідження
![]()
•  Білки були виділені в окремий клас біологічних молекул у 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати під час нагрівання або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці.
Білки були виділені в окремий клас біологічних молекул у 18 столітті в результаті робіт французького хіміка Антуана де Фуркруа та інших учених, в яких було відмічено властивість білків коагулювати під час нагрівання або під дією кислот. У той час були досліджені такі білки, як альбумін з яєчних білків, фібрин з крові і глютен із зерна пшениці.
•  Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
Голландський хімік Герріт Мульдер провів аналіз складу білків і виявив, що практично всі білки мають однакову емпіричну формулу. Мульдер також визначив продукти руйнування білків — амінокислоти — і для однієї з них (лейцину) майже точно визначив молекулярну масу — 131 дальтон.
• Мульдеру, зокрема, належить перша модель хімічної будови білків, запропонована ним у 1836 році. Виходячи з теорії радикалів, він сформулював поняття про мінімальну структурну одиницю у складі білків. Саме ця одиниця зі складом
C16H24N405 отримала пізніше назву «протеїну» (Pr), а концепція — теорії протеїну.
•  Сам термін «протеїн», що в сучасному розумінні означає білок більшістю європейських мов, був запропонований у 1838 році співробітником Мульдера Якобом
Сам термін «протеїн», що в сучасному розумінні означає білок більшістю європейських мов, був запропонований у 1838 році співробітником Мульдера Якобом
Берцеліусом. Перевірка цієї моделі привернула увагу відомих хіміків свого часу, таких як Юстус Лібіх і ЖанБатист Дюма. Під впливом нових даних теорія протеїну декілька разів корегувалася, але все ж до кінця 1850-х років від неї довелося повністю відмовитися.
•  До кінця 19 століття вже було досліджено більшість амінокислот, що входять до складу білків. У 1894 році німецький фізіолог Альбрехт Коссель висунув теорію, що амінокислоти є головними структурними елементами білків. На початку 20-го століття німецький хімік Еміль Фішер експериментально доказав, що білки збудовані з залишків амінокислот, сполучених пептидними зв'язками.
До кінця 19 століття вже було досліджено більшість амінокислот, що входять до складу білків. У 1894 році німецький фізіолог Альбрехт Коссель висунув теорію, що амінокислоти є головними структурними елементами білків. На початку 20-го століття німецький хімік Еміль Фішер експериментально доказав, що білки збудовані з залишків амінокислот, сполучених пептидними зв'язками.
• Також він здійснив перші аналізи амінокислотного складу білків та дав пояснення протеолізу. Після 1926 року також стала зрозумілою центральна роль білків в організмах, коли
американський хімік Джеймс Самнер (згодом — лауреат Нобелевскої премії) показав, що фермент уреаза також є білком.
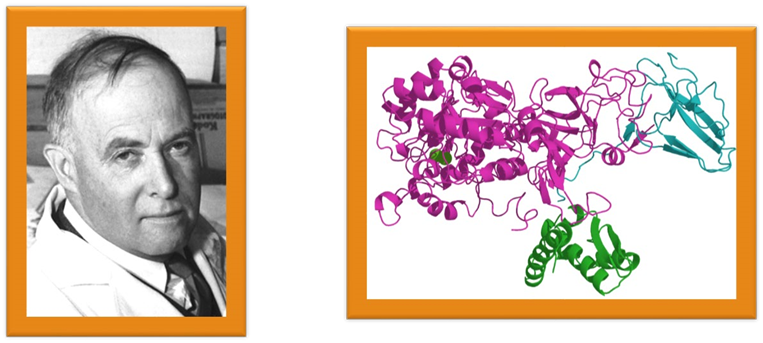
• Вивченню білків перешкоджала складність їхнього виділення. Тому перші дослідження білків проводилися з використанням тих поліпептидів, які могли бути очищені у великій кількості, тобто білків крові, курячих яєць, різних токсинів і травних/метаболічних ферментів, які можна було виділити в місцях забою худоби. У кінці 1950-х років компанія Armour Hot Dog Co. змогла очистити кілограм бичачої панкреатичної рибонуклеази А, яка стала експериментальним об'єктом для багатьох учених.

•  Ідея про те, що вторинна структура білків утворюється в результаті формування водневих зв'язків між амінокислотами, була висловлена Вільямом Астбері в 1933 році, але Лайнус Полінг вважається першим ученим, який зміг успішно передбачити вторинну структуру білків.
Ідея про те, що вторинна структура білків утворюється в результаті формування водневих зв'язків між амінокислотами, була висловлена Вільямом Астбері в 1933 році, але Лайнус Полінг вважається першим ученим, який зміг успішно передбачити вторинну структуру білків.
•  Пізніше Волтер Каузман, спираючись на роботи Кая Ліндерстрем-Ланга, зробив вагомий внесок до розуміння законів утворення третинної структури білків і ролі в цьому процесі гідрофобних взаємодій. У 1949 році Фред Сенгер визначив амінокислотну
Пізніше Волтер Каузман, спираючись на роботи Кая Ліндерстрем-Ланга, зробив вагомий внесок до розуміння законів утворення третинної структури білків і ролі в цьому процесі гідрофобних взаємодій. У 1949 році Фред Сенгер визначив амінокислотну
послідовність інсуліну, продемонструвавши таким способом, що білки — це лінійні полімери амінокислот, а не розгалужені (як у деякихцукрів) ланцюжки, колоїди або циклоли.
• Перші структури білків, що ґрунтуються на методах рентгеноструктурного аналізу на рівні окремих атомів,
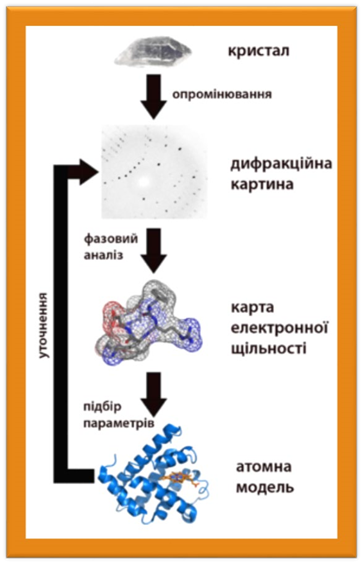 були отримані в 1960-х роках, а за допомогою ЯМРспектроскопії — в 1980-х роках. У 2006 році Банк даних білків (Protein Data Bank) містив приблизно 40 000 структур білків. У наш час кріоелектрона мікроскопіявеликих білкових комплексів за роздільною здатністю наближається до атомного рівня.
були отримані в 1960-х роках, а за допомогою ЯМРспектроскопії — в 1980-х роках. У 2006 році Банк даних білків (Protein Data Bank) містив приблизно 40 000 структур білків. У наш час кріоелектрона мікроскопіявеликих білкових комплексів за роздільною здатністю наближається до атомного рівня.

Будова
![]()
Склад
• Молекули білків є лінійними полімерами, що складаються з α-L-амінокислот (які є мономерами цих полімерів) і, в деяких випадках, з модифікованих основних амінокислот
(щоправда модифікації
відбуваються вже після синтезу білка на рибосомі). Для позначення амінокислот в науковій літературі використовуються одно- або трьохбуквені скорочення.
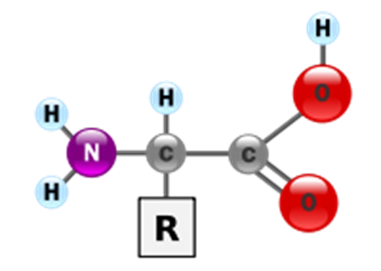
• Хоча на перший погляд може здатися, що використання «всього» 20 основних типів амінокислот обмежує різноманітність білкових структур, насправді кількість варіантів важко переоцінити: для ланцюжка всього з 5 амінокислот воно становить вже більше 3 мільйонів, а ланцюжок з 100 амінокислот (невеликий білок) може бути представлений більш ніж у 10130 варіантах (для порівняння — кількість атомів у Всесвіті оцінюється приблизно у 1080).
Поліпептидні ланцюжки завдовжки від двох до кількох десятків амінокислотних залишків зазвичай називають пептидами, при більшому ступені полімеризації — власне білками або протеїнами, хоча цей поділ вельми умовний.
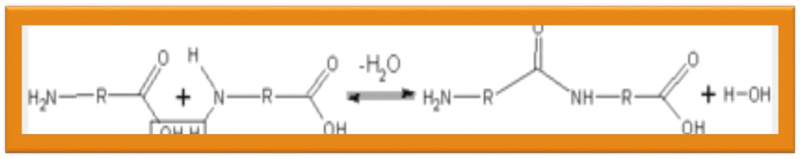
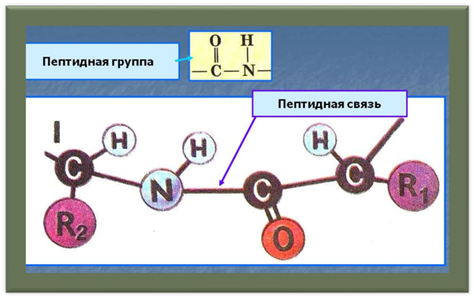
Схематичне зображення утворення пептидного зв'язку. Подібна реакція відбувається на рибосомі — молекулярній машині для складання білків.
• При утворенні білка в результаті взаємодії α-аміногрупи (-NH2) однієї амінокислоти з α-карбоксильною групою (-СООН) іншої амінокислоти утворюються пептидні зв'язки. Кінці білка називають С- і N- кінцями (залежно від того, яка з груп кінцевої амінокислоти вільна: COOH чи -NH2, відповідно).
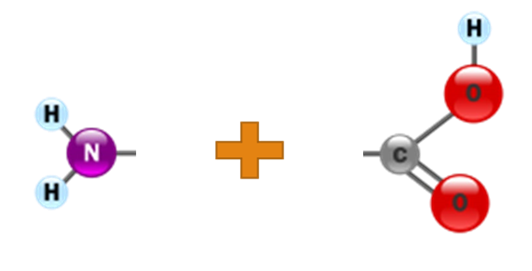
• При природному синтезі білка на рибосомі, нові амінокислоти приєднуються до C-кінця, тому назва пептиду або білка дається шляхом перерахування амінокислотних залишків починаючи з N-кінця.
• 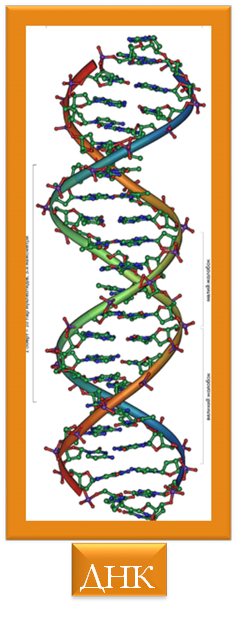 Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьох нуклеотидів — так званих кодонів. Те, яка амінокислота відповідає даному
Послідовність амінокислот у білку відповідає інформації, що міститься в гені даного білка. Ця інформація представлена у вигляді нуклеотидної послідовності, причому одній амінокислоті відповідає одна або декілька послідовностей з трьох нуклеотидів — так званих кодонів. Те, яка амінокислота відповідає даному
кодону в ДНК та мРНК(проміжній ланці біосинтезу білків), визначається генетичним кодом, який може дещо відрізнятися у різних організмів.
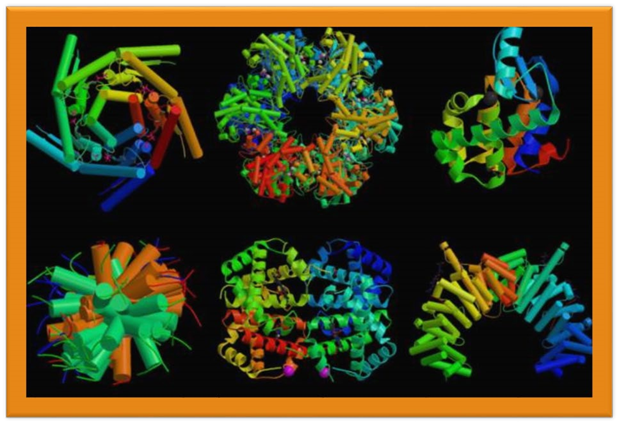
Рівні структури білків
• Окрім послідовності амінокислот поліпептиду (первинної структури), для функціонування білків украй важлива тривимірна структура, яка формується в процесі згортання білків . Ця структура утримується в результаті взаємодії структур нижчих рівнів. Тривимірна структура білків за нормальних природних умов називається нативним станом білка. Хоча чимало білків здатні згортатися та приймати нативний стан самостійно, завдяки властивостям свого поліпептидного ланцюжка, інші вимагають допомоги інших білків, молекулярних шаперонів.
До 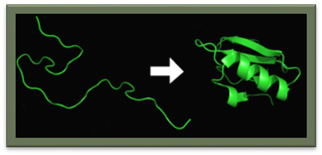 Після
Після
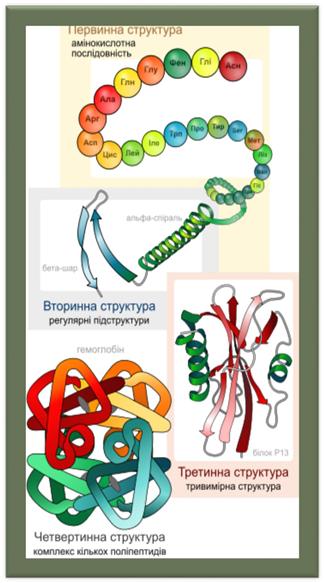 Виділяють чотири рівні структури білків:
Виділяють чотири рівні структури білків:
§ Первинна § Вторинна § Третинна § Четвертинна
Первинна структура
 — пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка.
— пептидна або амінокислотна послідовність, тобто послідовність амінокислотних залишків у пептидному ланцюжку. Саме первинна структура кодується відповідним геном і найбільшою мірою визначає властивості сформованого білка.
Вторинна структура
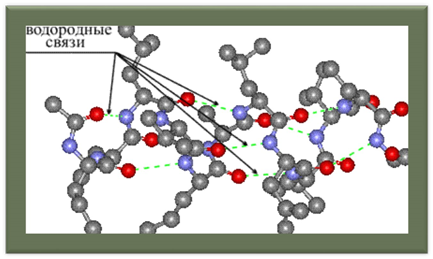
— локальне впорядковування фрагменту поліпептидного ланцюжка, стабілізоване водневими зв'язками і гідрофобними взаємодіями. Найпоширеніші типи вторинної структури білків включають: α-спіралі і β-листи. Інші елементи вторинної структури включають π-спіралі, 310-спіралі, повороти, невпорядковані фрагменти та інші. Найпоширеніша єдина класифікація таких структур — номенклатура DSSP.
 Третинна структура
Третинна структура
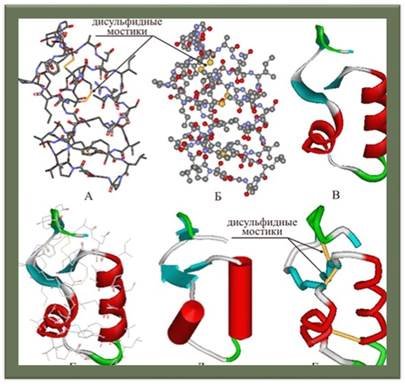
— повна просторова будова цілої білкової молекули, просторове взаємовідношення вторинних структур одна до одної. Третинна структура загалом стабілізується нелокальними взаємодіями, найчастіше формуванням гідрофобного ядра, а також завдяки утворенню водневих зв'язків, солевих містків, інших типів іонних взаємодій, дисульфідних зв'язків між залишками цистеїну.
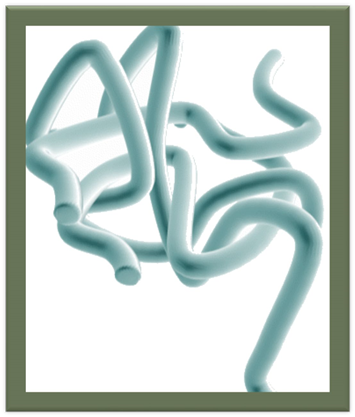 • До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка.
• До третинної структури зазвичай відносять і проміжні рівні між основними елементами вторинної структури та повною структурою білка — «надвторинну» структуру, що складається із структурних мотивів та доменів. Структурні мотиви — невеликі усталені поєднання кількох елементів вторинної структури, що мають схожу структуру, важливу для виконання білком певних функцій. Схожі структурні мотиви зазвичай виконують схожі функції, завдяки чому за ними можна передбачити функцію невідомого білка.
Четвертинна структура
 — структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом.
— структура, що виникає в результаті взаємодії кількох білкових молекул, які в даному контексті називають субодиницями. Повна структура кількох поєднаних субодиниць, що разом виконують спільну функцію, називається білковим комплексом.
Розміри
• Розмір білка може вимірюватися за числом амінокислот або в одиницях молекулярної маси —дальтонах — Да. Найбільшим відомим одиничним білком є тітін, що містить понад 29 тис. амінокислот і має молекулярну масу 3 МДа, а найбільший внутрішньоклітинний білковий комплекс —комплекс ядерної пори хребетних тварин — має масу біля 125 МДа.
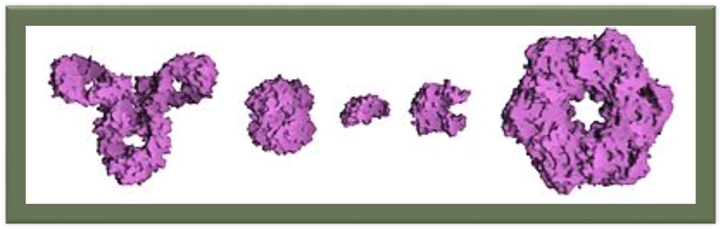
Порівняльні розміри білків та пептидів. Зліва направо: Антитіло(IGG), гемоглобін, інсулін (гормон), аденілаткіназа (фермент) і глютамінсинтетаза (фермент).
Денатурація білків
• Як правило, білки протягом досить довгого часу зберігають структуру і, отже, фізико-хімічні властивості, наприклад, розчинність, в умовах (таких як pH, температура), до яких пристосований даний організм або які підтримуються в його межах в результаті збереження гомеостазу. Різка зміна цих умов, наприклад, внаслідок нагрівання або обробки білка кислотою чи лугом, приводить до втрати четвертинної, третинної і вторинної структур білка, цей процес називається денатурацією. Відомий випадок денатурації білка в побуті — приготування курячого яйця, коли під впливом високої температури розчинний у воді прозорий білок овальбумін стає щільним, нерозчинним і непрозорим.
|
|
|
Використання людиною
![]()
Харчування
• Білки надходять в організм разом з їжею й служать основним джерелом амінокислот. Обов'язкове використання білків у їжі обумовлене потребою в незамінних амінокислотах, які не можуть синтезуватися людиною з інших речовин. Травлення починається з кислотної денатурації білків у шлунку — необхідної стадії для кулінарно неопрацьованої їжі. Денатуровані білки стають субстратом для протеаз, спочатку в шлунку, а потім у слаболужньому середовищі тонкого кишечнику.

• Борщ — джерело різноманітних денатурованих рослинних і тваринних білків.

 Білкові лікувальні препарати
Білкові лікувальні препарати
|
Суміш для нарощування м'язів (США) містить білки молочної сироватки. |
• Значна кількість досліджень у медицині направлена на використання білків в якості терапевтичних препаратів та засобів діагностики захворювань. Фармацевтичне застосування білків почалося з природних білків отриманих з різноманітних живих організмів. Нові препарати створюються штучно, рекомбінантними методами або за допомогою проектування білків.


про публікацію авторської розробки
Додати розробку

