Йонний, ковалентний, металічний, водневий хімічні зв’язки.
11 клас
Урок № 8
Тема: Йонний, ковалентний, металічний, водневий хімічні зв’язки.
Мета:
- освітня: сформувати уявлення учнів про єдину природу хімічного зв'язку; познайомити учнів з різними типами хімічних зв'язків; навчити учныв визначати типи хімічних зв'язків в різних сполуках.
- розвивальна: продовжити розвивати уявлення про хімічний зв’язок та його види на прикладі йонного, металічного та водневого хімічних зв’язків; порівнювати типи зв’язків та підкреслювати суттєві відмінності між ними;
- виховна: виховувати самостійність, уважність, відповідальність в учнів.
Матеріали та обладнання: Періодична система хімічних елементів Д.І. Менделєєва, робочі зошити, ручки, підручники, картки.
Очікувані результати: На кінець уроку учні:
- називають типи хімічних зв’язків;
- розрізняють та порівнюють типи хімічних зв’язків;
- називають приклади речовин, яким характерний, той, чи інший хімічний зв’язок.
Компетентності: спілкування державною мовою (формулювати відповідь на поставлене запитання, робити висновки), математична компетентність (використовувати логічне мислення, зокрема, для пошуку хімічних елементів за певним порядком та класифікацією), основні компетентності у природничих науках (виконувати творчі завдання на засвоєння поширених хімічних елементів).
Тип уроку: комбінований.
ХІД УРОКУ
Організаційний етап уроку
Вчитель вітається з учнями, записує відсутніх до журналу.
І. Актуалізація опорних знань учнів
Оголошення оцінок за самостійну роботу.
- Де в ПС розташовані атоми, яким легше віддавати електрони?
- Де в ПС розташовані атоми, яким легше приєднати електрони?
- Як визначити кількість електронів на зовнішньому енергетичному рівні?
- Які атоми мають завершений енергетичний рівень?
ІІ. Мотивація навчальної діяльності учнів
- Чому складові нашої планети - азот і кисень - не взаємодіють між собою? (Справа в тому, що азот інертний в хімічному відношенні за рахунок потрійного зв'язку в молекулі N = N, тому для його взаємодії з киснем необхідна дуже висока температура).
ІІІ. Повідомлення теми, мети уроку
Вчитель записує тему на дошці, називає мету уроку разом з учнями.
ІV. Вивчення нового матеріалу
- Йонний хімічний зв’язок.
Йони – це електрично заряджені частинки речовини, які утворюються з атомів або груп атомів у результаті віддачі або приєднання до них електронів.
Йонний зв'язок
Йонний хімічний зв'язок — це тип зв'язку, при якому електрони переходять із одного атома до іншого, й основний вклад в притягання вноситься електростатичною взаємодією.
Хімічний зв'язок, утворений з допомогою електростатичної взаємодії йонів, називається йонним зв’язком.
Характеристика йонного зв’язку
А) неспрямований.
Б) ненасичений.
В) речовини з йонним зв’язком це тверді речовини з високою температурою плавлення.
Механізм утворення йонного зв’язку.
Розглянемо механізм утворення йонного зв'язку на прикладі взаємодії атомів Натрію і Хлору.

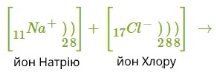
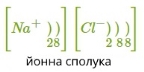
Na0+Cl0→Na++Cl−→Na+Cl−
Позитивно заряджений йон називається катіон.
Негативно заряджений йон називається аніон.
Таке перетворення атомів на йони відбувається завжди при взаємодії атомів типових металів і типових неметалів, електронегативності яких суттєво відрізняються.
Йонний зв'язок утворюється в складних речовинах, що складаються з атомів металів і неметалів.
Розглянемо інші приклади утворення йонного зв'язку.
Приклад:
Взаємодія Кальція і Флуора
1. Кальцій — елемент головної підгрупи другої групи. Йому легше віддати два зовнішніх електрони, ніж прийняти 6 електронів, яких не вистачає до завершення зовнішнього рівня.

2. Флуор — елемент головної підгрупи сьомої групи. Йому легше прийняти один електрон, ніж віддати сім.
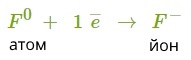
3. Знайдемо найменше спільне кратне між зарядами йонів, що утворюються. Воно дорівнює 2. Визначимо число атомів Флуору, які візьмуть два електрони від атома Кальцію: 2 : 1 = 2.
4. Складемо схему утворення йонного зв'язку:
Ca0+2F0→Ca2+F−2.
Приклад:
Взаємодія Натрію і Оксигену
1. Натрій — елемент головної підгрупи першої групи. Він легко віддає один зовнішній електрон.

2. Оксиген — елемент головної підгрупи шостої групи. Йому легше прийняти два електрони, ніж віддати шість.
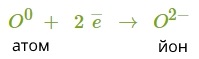
3. Знайдемо найменше спільне кратне між зарядами йонів, що утворюються. Воно дорівнює 2 : 1 = 2. Визначимо число атомів Натрію, які віддадуть два електрони атому Оксигену: 2.
4. Складемо схему утворення йонного зв'язку:
2Na0+O0→Na+2O2−
За допомогою йонного зв'язку утворюються також сполуки, в яких є складні йони:
NH4+,NO3−,OH−,SO42−,PO43−,CO32−.
Отже, йонний зв'язок існує в солях і основах.
Зверни увагу!
Солі амонію NH4NO3,NH4Cl,(NH4)2SO4 не містять металу, але утворенні за допомогою йонного зв'язку.
- Металічний хімічний зв’язок.
Металічний зв'язок це багато центровий зв'язок. Який існує у металах та їх сплавах між позитивними йонами та валентними електронами, що є спільними для всіх йонів.
У металів енергія йонізації атомів нижча, ніж у неметалів, тому в них валентні електрони легко відриваються від окремих атомів і стають спільними для всього кристалу. Згідно теорії вільних електронів у вузлах решітки металів знаходяться позитивно заряджені йони,а в об’ємі перебуває «електронний газ»(електрони). Тому валентні електрони не локалізовані, а між позитивно зарядженими йонами і нелокалізованими електронами існує електростатична взаємодія, яка обумовлює стійкість речовини.
В основі виникнення металічного зв’язку лежать процеси утворення спільних валентних електронів, які є спільними для всього кристалу.
Металічний зв'язок є не напрямленим, оскільки валентні електрони розподілені по кристалу рівномірно. Стабільність кристалічних ґраток обумовлена електростатичним притяганням йонів і узагальнених електронів, що неперервно рухаються між йонами. Енергія металічного зв’язка у менша за енергію ковалентного зв’язку.
Наявність електронів, що можуть вільно рухатися по об’єму кристалу, обумовлює високі тепло- та електропровідність, ковкість та пластичність.
- Водневий хімічний зв’язок.
Водневий зв’язок – хімічний зв’язок, що виникає між атомами Гідрогену і атомами сильно електронегативних елементів (F, O, N)
або
Водневий зв’язок – електростатична взаємодія між молекулами за участю атомів Гідрогену.
Молекули води – диполі, притягуються одна до одної, а саме, атоми Н однієї молекули до атомів О іншої, оскільки мають протилежні заряди.
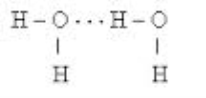
Водневий зв’язок позначається крапками
Слабший за ковалентний зв’язок
Легко розривається при випаровуванні води.

Наявність водневих звяʾзків впливає на властивості речовини: підвищена температура кипіння та плавлення, густина, теплоємність, висока розчинність речовини у воді.
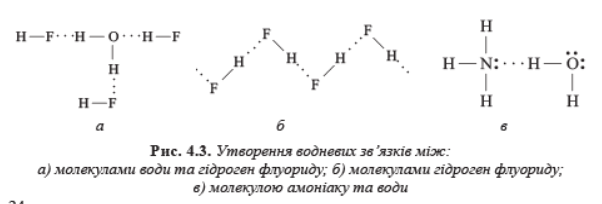
Водневий звʾязок утворюється не лише між молекулами води. Він утворюється між молекулами гідроген флуориду, амоніаку, етилового спирту, оцтової кислоти (міжмолекулярний водневий звʾязок), а також в середині молекул між окремими атомами, наприклад в молекулах білків, нуклеїнових кислот( внутрішньомолекулярний водневий звʾязок). Якщо речовина розчинна у воді, то між її молекулами та молекулами води також виникає водневий звʾязок.
- Залежність фізичних властивостей речовин від типу хімічного зв’язку.
Між будовою речовини, яка визначається типом хімічного зв'язку і типом кристалічних ґраток, та її властивостями існує певна залежність: чим міцніший хімічний зв'язок, що утримує частинки у вузлах кристалічних ґраток, тим міцніші кристали, тим твердіша речовина, тим вищі її температури плавлення і кипіння. А тому, якщо відома будова речовини, можна прогнозувати її властивості, і навпаки – якщо відомі властивості речовини, можна зробити висновок про її можливу будову.
V. Первинне застосування придбаних знань
Виберіть речовину з йонним хімічним зв’язком. Відповідь обґрунтуйте
(напишіть схему утворення хімічного зв’язку):
а) HCl;
б) O2;
в) MgS;
г) SO2.
Виберіть рядок, в якому перелічені сполуки з йонним хімічним зв’язком:
а) H2O, HCl, H2S, NH3;
б) H2, O2, N2, Cl2;
в)KCl, NaBr, CaS, Li2O;
г) Zn, SO2, P, SiH4
VI. Застосування учнями знань і дій у стандартних умовах з метою засвоєння навичок
Які формули відповідають речовинам, молекули яких здатні сполучатися водневими зв’язками: СО2, NH3, SCl4, СН3OН, H2SO4, Н2, O3?
- Між атомами яких елементів можуть існувати водневі зв’язки в молекулах білків?
- Розгляньте варіанти утворення водневих зв’язків між молекулою метанової кислоти і молекулою води. Зобразіть ці зв’язки, використавши структурні формули молекул.
- Як пояснити те, що етан за звичайних умов є газом, а метанол — рідиною, хоча маса молекули вуглеводню майже така сама, що й молекули спирту?
- Електрони в металі рухаються хаотично. За якої умови рух електронів стає спрямованим і виникає електричний струм?
- Напишіть загальні формули катіонів, які можуть міститися в лужних і лужноземельних металах (мал. 10). Використайте символ металічного елемента М.
- Чому, на вашу думку, металічний зв’язок не реалізується в неметалах?
- Який неметал, що проводить електричний струм, ви знаєте?
VII. Творчий перенос знань і навичок у нові або змінені умови з метою формування вмінь
Перевірка рівня досягнення учнів з вивченої теми.
I. Гра « Вірю –не вірю»
- Йонний зв’язок виникає між йонами.
- Йони – це нейтральні частинки.
- Йони – це заряджені частинки.
- Ковалентний зв’язок буває двох типів – полярний і неполярний
- Ковалентний полярний зв’язок утворюється між атомами з однаковою
- електронегативністю.
- Ковалентний неполярний зв’язок утворюється між атомами одного і того ж
- неметалу.
- Ковалентний неполярний зв’язок утворюється між атомами з різною
- електронегативністю.
- NaCl – сполука з йонним зв’язком.
- О2 – сполука з ковалентним полярним зв’язком.
- HCl –сполука з йонним зв’язком.
II. Вкажіть тип хімічного зв’язку (підкресленням) в кожній з наведених сполук:
СаО, S8, SiO2, KCl, CCl4, O2, N2, CO, Na3N, K2SO4, СО, Al2S3, SiO2, KCl, CH4, H2, F2, NO, Na3N, Na2SO3.
VIII. Підсумки уроку
Отже, ми з вами повторили типи хімічних зв’язків, їх особливості та поширення серед органічних і неорганічних речовин.
IX. Повідомлення домашнього завдання
Опрацювати параграф 5. Ст. 30-34. Впр. 39. Параграф 7. Ст. 41-45.


про публікацію авторської розробки
Додати розробку
