Електричний струм у рідинах
Електричний струм у рідинах
У посудину з дистильованою водою опустимо два електроди. Зберемо коло із джерела струму, ключа, лампочки та чутливого амперметра. Якщо замкнути коло, то стрілка амперметра не відхилиться. Це означає, що дистильована вода не містить вільних носіїв заряду й у колі немає струму.
У такий же спосіб можна переконатися, що суха кам’яна сіль так само є діелектриком.
А тепер «об’єднаємо» ці два діелектрики: насиплемо у посудину з водою дві-три ложки кам’яної солі. Ми побачимо, що лампочка загориться, причому в міру розчинення солі розжарення лампи збільшується.
Цей дослід доводить, що підсолена вода є провідником, причому носії заряду з’являються під час розчинення солі у воді.
За допомогою подібних дослідів можна визначити, що практично усі водні розчини солей, кислот і лугів є провідниками електричного струму.
Електроліти — речовини, водні розчини або розплави яких проводять електричний струм.
Молекула води полярна, тобто її можна уявляти об’єктом видовженої форми, на кінцях якого зосереджено електричні заряди протилежних знаків.
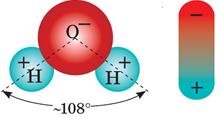
Молекули солей, кислот і лугів утворені позитивними й негативними йонами, що утримуються силами електростатичного притягування.
Наприклад, у молекулах кухонної солі NaCl позитивно заряджений йон натрію Na притягується до негативного йона хлору Cl. У водяному розчині молекули води послаблюють зв’язок між йонами.
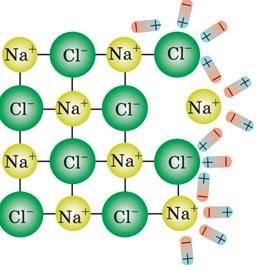
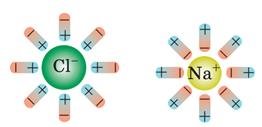
При зіткненнях, обумовлених тепловим рухом, молекула розпадається на позитивні й негативні йони, що стають носіями заряду в електроліті.
Таким чином, носіями заряду в електролітах є йони, тобто електроліти мають йонну провідність.
Електролітична дисоціація — розщеплення молекул на йони у водному розчині або в розплаві.
Зі збільшенням температури ступінь дисоціації зростає, а, отже, збільшується концентрація позитивно і негативно заряджених іонів.
У розчині може відбуватися також процес, що називається рекомбінацією.
Рекомбінація — процес з'єднання йонів у нейтральні молекули.
Візьмемо два вугільні електроди та з’єднаємо їх із полюсами джерела струму.
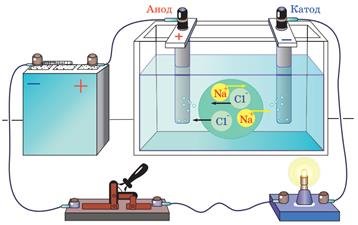
Електрод, з’єднаний із позитивним полюсом джерела струму, називають анодом, а електрод, з’єднаний із негативним полюсом, — катодом.
Опустимо електроди в посудину з електролітом, наприклад, із водним розчином кухонної солі (NaCl), і замкнемо коло. У розчині виникне електричне поле, через дію якого вільні позитивні йони Натрію (Naplus) попрямують до катода, а вільні негативні йони Хлору (Clminus) — до анода. Отже, в розчині виникне напрямлений рух вільних заряджених частинок — електричний струм.
Електричний струм в електролітах — це напрямлений рух позитивних і негативних йонів.
Під час проходження струму через електроліт:
позитивні йони рухаються до негативного електрода — катода, тому їх називають катіонами;
негативні йони рухаються до позитивного електрода — анода, і їх відповідно називають аніонами.
Зазначимо, що зі збільшенням температури кількість йонів у електроліті збільшується, відповідно збільшується й сила струму.
При нагріванні електроліту сила струму збільшується, отже опір зменшується.
Якщо струм проходить крізь розчин мідного купоросу, то із часом виявимо, що на катоді утворився тонкий шар міді.
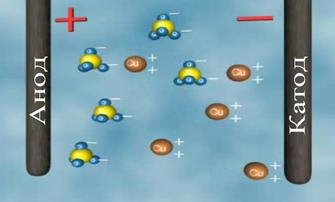
Отже, у розчині під дією електричного поля до катода переміщаються позитивно заряджені йони міді, які під час контакту з катодом приєднують до себе недостатні електрони й нейтралізуються. Нейтральні атоми, що утворилися, осідають на електроді. Бачимо, що на відміну від металів струм в електроліті супроводжується перенесенням речовини.
Електроліз — це процес виділення речовин на електродах, пов'язаний з окисно-відновними реакціями, які відбуваються на електродах під час проходження струму.
У 1833−1834рр. видатний англійський учений Майкл Фарадей експериментально встановив кількісні співвідношення явища електролізу.
Перший закон Фарадея
Маса речовини, яка виділяється на електроді, прямо пропорційна заряду, який пройшов через електроліт.
m = kq
m — маса речовини;
k — електрохімічний еквівалент;
q — електричний заряд.
Електрохімічний еквівалент чисельно дорівнює масі певної речовини, яка виділяється на електроді внаслідок проходження через електроліт заряду 1Кл.
[k] = кг/Кл
Електроліз широко застосовують у промисловості.
За допомогою електролізу:
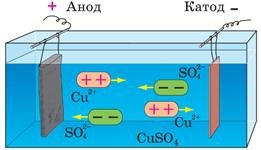
Очищають метали (рафінування) (мідь, срібло тощо).
Рафінування міді: тонка пластинка чистої міді є катодом, товста пластинка неочищеної міді — анодом; ванна наповнена водним розчином купрум (II) сульфату.
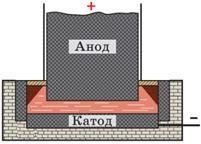
Одержують метали (цинк, алюміній, мідь тощо).
Розглянемо схему промислового пристрою виробництва алюмінію. Дно та стінки ванни слугують катодом; алюміній збирається на дні ванни. Вугільний блок слугує анодом, на ньому виділяється кисень.
За допомогою електролізу можна наносити тонкий шар металу на поверхню виробу — робити сріблення, золочення, нікелювання, хромування тощо. Такий шар може захищати від корозії, збільшувати міцність виробу або просто ставати його прикрасою.
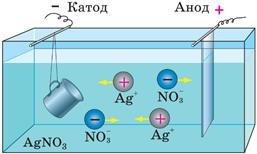
Гальваностегія — електролітичний спосіб покриття виробу тонким шаром металів.
Розглянемо гальванічне сріблення. Предмет, який покривають сріблом (кухоль), є катодом, срібна пластинка — анодом; ванна наповнена розчином аргентум (I) нітрату
Гальванопластика — це отримання за допомогою електролізу точних копій рельєфних виробів.
Розглянемо отримання рельєфних копій за допомогою електролізу:
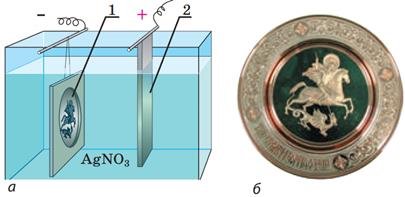
а — схема пристрою: восковий зліпок, покритий тонким шаром графіту, є катодом (1), срібна пластинка — анодом (2); ванна наповнена розчином аргентум (I) нітрату;
б — одержана копія
Джерела:
Фізика : підруч. для 8 кл. загальноосвіт. навч. закл. / [В. Г. Бар’яхтар Я. Божинова, С. О. Довгий, О. О. Кірюхіна] ; за ред. В. Г. Бар’яхтара О. Довгого. — X. : Вид-во «Ранок», 2016. — 240 с. : іл., фот.
Фізика : підруч. для 8 кл. загальноосвіт. навч. закладів / Т. М. Засєкіна, Д. О. Засєкін. — К. : УОВЦ «Оріон», 2016. — 256 с.
https://www.fizikanova.com.ua


про публікацію авторської розробки
Додати розробку
