Електричний струм у розчинах і розплавах електролітів. Закон електролізу.
Тема: Електричний струм у розчинах і розплавах електролітів. Закон електролізу.
Мета: пояснити природу електричного струму в розчинах і розплавах електролітів; показати практичне застосування електролізу, спостерігати явища, викликані електричним струмом у різних середовищах; сформулювати закон електролізу; продовжувати виховувати інтерес до предмету.
Тип: комбінований.
План уроку:
1. Перевірка домашнього завдання.
2. Вивчення нового матеріалу.
3. Закріплення вивченого матеріалу.
4. Домашнє завдання.
1. Перевірка домашнього завдання.
Проведення дискусії за повідомленнями учнів, які були задані додому.
2. Вивчення нового матеріалу.
Провідники електрики поділяються:
1. Провідники першого роду. Це провідники, під час проходження струму в яких не відбувається ніяких хімічних перетворень:
- метали;
- вакуумні прилади;
- напівпровідники.
2. Провідники другого роду. Це провідники, під час проходження струму в яких відбувається хімічні перетворення:
- електроліти;
- йонні напівпровідники.
Електроліти – хімічні речовини, або їх системи, в яких проходження електричного струму зумовлене переміщенням йонів.
Електроліти поділяються:
- тверді (йодисте срібло);
- рідкі (розчини солей, кислот, лугів у воді та неводних розчинах);
- розплавленні (натрій гідроксид, магній хлорид).
Електролітична дисоціація – це процес взаємодії розчинюваної речовини і розчинника,під час якого значно послаблюється взаємодія між йонами розчинюваної речовини і молекула може розпастися йони.
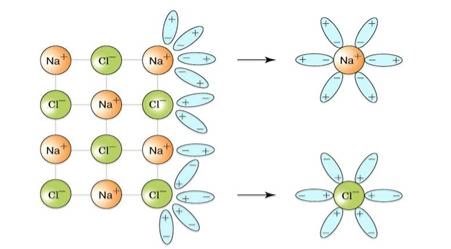
Молекула води розчиняється у воді, вона є полярною. Складається з позитивного зарядженого йона натрію і негативно зарядженого йона хлору.
Частина йонів знову може об’єднуватися в молекули – цей процес називається рекомбінацією.
Сольватація – взаємодія між частинками (йонами, молекулами) розчинника і розчиненої речовини.
Електроліз
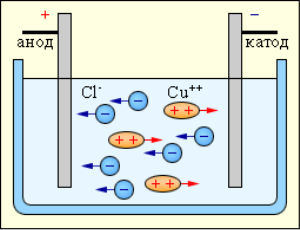 У 1800 році У. Нікольсон і А. Карлейль відкрили електроліз. Під час проходження струму у воді, вода розкладається на водень і кисень.
У 1800 році У. Нікольсон і А. Карлейль відкрили електроліз. Під час проходження струму у воді, вода розкладається на водень і кисень.
Аніони – негативно зарядженні йони, що рухаються до анода.
Катіони – позитивно зарядженні йони, що рухаються до катода.
Під час проходження струму через електроліт йони прямують до електродів, де можуть: виділятися на електродах, нейтралізуватися на них, вступати у вторинні реакції з електродами або з розчинником. Продукти вторинних реакцій виділяються на електродах або переходять у розчин.
У спрощеному розумінні: виділення на електродах складових електроліту під час проходження струму в ньому називається електролізом.
Закон електролізу
Маса речовини m, що виділяється на аноді або катоді під час проходження електричного струму в електролітах, прямо пропорційна заряду q, який при цьому переноситься йонами електроліту.
m = k q
k = m / q
[k] = кг / Кл
Електрохімічний еквівалент k показує, яка маса даної речовини в 1 кг виділилась на електроді при перенесенні заряду.
I = q / t
q = I t
m = k I t
Застосування електролізу:
1. Електрометалургія. За допомогою електролізу отримують алюміній з розплавлених руд. У процесі електролізу одержують натрій, магній, кальцій.
2. Рафінування. Очищення металів. Для цього метал відливають у пластини і роблять їх анодами в електролітичних ваннах. Електроліт – розчин солі даного металу. За певних значень густини струму лише чистий метал виділяється на катоді. Домішки випадають в осад, з них також добувають корисні речовини.
3. Гальванопластика. Це осадження металу на поверхні різних тіл для відтворення їх форми: форми для відливання деталей, скульптур, друкарських кліше.
4. Гальваностегія – електролітичне нанесення певних металів чи інших речовин з метою їх захисту від корозії, відповідного оздоблення (покриття сріблом, золотом, платиною)
3. Закріплення вивченого матеріалу.
![]() Задача 1. Скільки срібла осіло на катоді установки, якщо процес електролізу тривав 10 хв при силі струму 25 А?
Задача 1. Скільки срібла осіло на катоді установки, якщо процес електролізу тривав 10 хв при силі струму 25 А?
![]() m - ? m = I k t t = 10 хв = 600 с [m] = А (кг / Кл) с = кг
m - ? m = I k t t = 10 хв = 600 с [m] = А (кг / Кл) с = кг
I = 25 А m = 1,12 · 10 – 6 600 · 25 = 16,8 · 10 – 3 кг k = 1,12 · 10 – 6 кг / Кл
Задача 2. За який час на катоді електролітичної установки виділилось 40 г хрому, якщо електроліз проходить при силі струму 25 А?
![]()
![]() t - ? m = I k t
t - ? m = I k t
m = 40 г = 40 · 10 – 3 кг t = m / k I
I = 25 А [t] = кг / ((кг / Кл) А) = с
k = 0,18 · 10 – 6 кг / Кл t = 40 · 10 – 3 / (0,18 · 10 – 6 · 25) = 9 103 с
![]() Задача 3. Визначте масу срібла, яке виділилось на катоді під час електролізу азотнокислого срібла за 1 год, якщо до установки підведено напругу 1,2 В, а опір ванни 5 Ом.
Задача 3. Визначте масу срібла, яке виділилось на катоді під час електролізу азотнокислого срібла за 1 год, якщо до установки підведено напругу 1,2 В, а опір ванни 5 Ом.
![]() m - ? m = I k t t = 1 год = 3600 с I = U / R
m - ? m = I k t t = 1 год = 3600 с I = U / R
U = 1,2 В m = (U / R) k t
R = 5 Ом [m] = (В / Ом) (кг / Кл) с = кг k = 1,12 · 10 – 6 кг / Кл m = (1,2 / 5) 1,12 · 10 – 6 · 3600 = 0,001 кг = = 1 г
Задача 4. У двох окремих посудинах електролітичним способом наносять мідь і срібло. Сила струму є однаковою. Яка маса мідного покриття, якщо маса срібного дорівнювала 40,24 г.
![]()
![]() m2 - ? m = I k t m1 = 40, 24 г = m1 = I1 k1 t1 = 40, 24 · 10 – 3 кг m2 = I2 k2 t2
m2 - ? m = I k t m1 = 40, 24 г = m1 = I1 k1 t1 = 40, 24 · 10 – 3 кг m2 = I2 k2 t2
I1 = I2 (m1 / m2) = (k1 / k2) k1 = 1,12 · 10 – 6 кг / Кл m2 = (m1 k2) / k1 k2 = 0,33 · 10 – 6 кг / Кл [m2] = (кг (кг / Кл)) / (кг / Кл) = кг
m2 = (40, 24 · 10 – 3 · 0,33 · 10 – 6) / 1,12 · 10 – 6 = 11,86 · 10 – 3 кг = 11,86 г
4. Домашнє завдання: опрацювати §23.


про публікацію авторської розробки
Додати розробку
