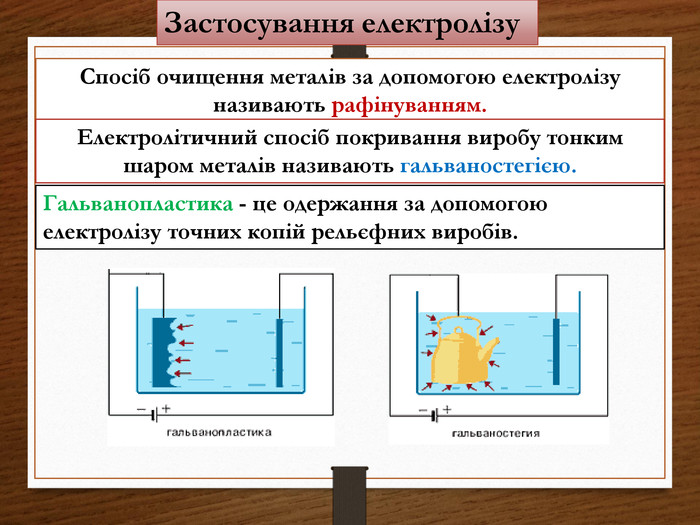
Електричний струм в електролітах
Мета уроку: Навчальна: Продовжувати формувати уявлення про природу електричного струму в розчинах і розплавах електролітів та процесу електролізу; з’ясувати фізичний зміст законів електролізу Фарадея, поняття електрохімічного еквівалента; ознайомити учнів з практичним застосуванням електролізу. Розвивальна. Сприяти збагаченню словникового запасу; формуванню пізнавальної самостійності; розвитку спостережливості, уваги, пам’яті, уяви, мислення; виробленню звички до планування своїх дій. Виховна. Виховувати уважність, зібраність, спостережливість.
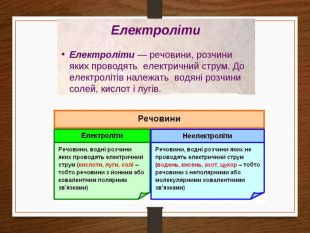
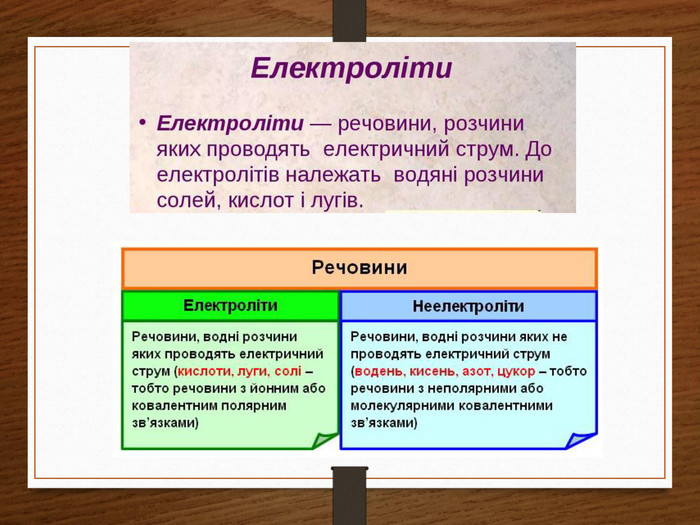
Чим же обумовлена провідність електролітів? При наявності електричного поля молекула солі розпадеться на два іони позитивний і негативний – цей процес називається дисоціацією. Якщо прибрати зовнішнє електричне поле, то іони знов з’єднаються в одну молекулу солі – цей процес називається рекомбінацією.
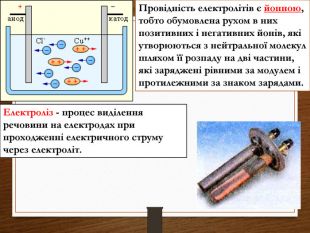
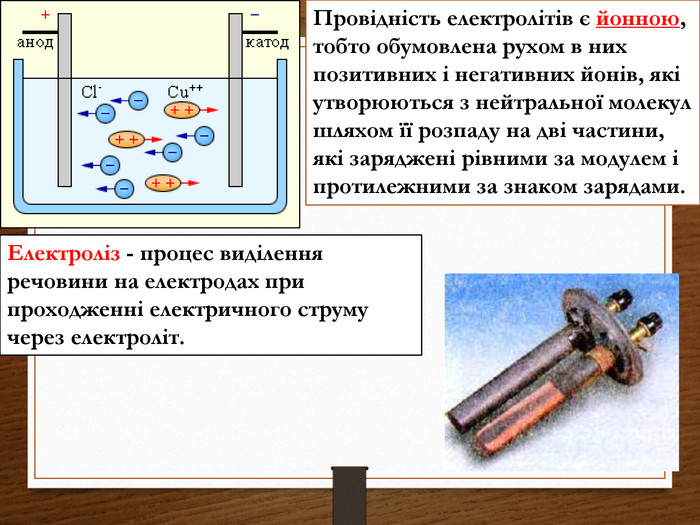
Провідність електролітів є йонною, тобто обумовлена рухом в них позитивних і негативних йонів, які утворюються з нейтральної молекул шляхом її розпаду на дві частини, які заряджені рівними за модулем і протилежними за знаком зарядами. Електроліз - процес виділення речовини на електродах при проходженні електричного струму через електроліт.
Як кількісно описати процес електролізу? Питанням дослідження явища електролізу займались багато вчених, одним з яких був Майкл Фарадей. Саме Фарадей з допомогою багатьох експериментів кількісно описав основні процеси, які відбуваються при електролізі. Перший закон Фарадея: Маса речовини, яка виділилась на електроді під час електролізу, прямо пропорційна силі струму та часу, проходження струму через електроліт: 𝒎=𝒌𝒒 де, m– маса речовини, яка виділилась на електроді; q – заряд, який пройшов через електроліт; k – коефіцієнт пропорційності, який залежить від речовини, яка виділяється на електроді. Оскільки 𝐼= 𝑞𝑡 , тоді 𝒎=𝒌𝑰𝒕


про публікацію авторської розробки
Додати розробку





![Сталу k називають електрохімічним еквівалентом речовини, який чисельно дорівнює масі речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А. Одиниця вимірювання: [k] = 1кг/Кл Сталу k називають електрохімічним еквівалентом речовини, який чисельно дорівнює масі речовини, яка виділяється на електроді за 1 с під час проходження через електроліт струму силою 1 А. Одиниця вимірювання: [k] = 1кг/Кл](/uploads/files/220728/255543/275553_images/7.jpg)