Хімічні джерела струму
ЛУБЕНСЬКИЙ ЦЕНТР ПРОФЕСІЙНОЇ ОСВІТИ
РФ «ПІВДЕННА ЗАЛІЗНИЦЯ»
Конспект навчального матеріалу з предмету «Електротехніка і електровимірювання» для груп підвищення кваліфікації машиністів ______
Тема 2. Хімічні джерела струму.
Заняття 3. Хімічні джерела струму. Акумулятори.
План заняття:
- Хімічні джерела струму.
- Акумулятори.
1. Хімічні джерела струму.
Хімічні процеси, унаслідок перебігу яких утворюється електрична енергія (електричний струм) або, навпаки, коли вони виникають під дією електричного струму, називаються електрохімічними.
Перетворення хімічної енергії окисно-відновних реакцій в електричну відбувається в хімічних джерелах струму (ХДС) - пристроях , різної конструкції, це, зокрема гальванічні елементи, акумулятори
Гальванічними елементами називають пристрої, що реалізують пряме окисно-відновне перетворення хімічної енергії наявних там реагентів в електричну. Реагенти (окисник і відновник) у процесі роботи таких елементів витрачаються повністю й безповоротно, а відтак являють собою джерела струму одноразової дії.
Принцип дії гальванічного елемента базується на різній хімічній активності двох, наявних у ньому металевих на півелементів, або електродів.
У такому пристрої відбуваються реакції окиснення й відновлення, вони фізично відділені одна від одної, так що електрони мають рухатися по зовнішньому колу, і це дозволяє вимірювати їхню енергію перенесення від цинку до купруму. Соляний місток, що з'єднує два напівелементи, складається із скляної трубки, заповненої агар-агаром (рослинною желеподібною речовиною), змішаним з електролітом KCl. Ця суміш створює контакт між двома розчинами і являє собою електричний провідник, по якому іони можуть рухатися із середовища одного напівелемента в порожнину іншого. Металеві провідники, з’єднуючи електроди з вольтметром, замикають електричне коло.
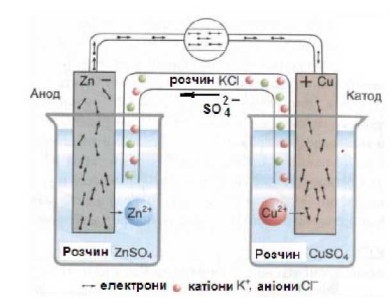
Електрод називають анодом, коли на ньому відбувається реакція окиснення, тобто
![]()
*Цинковий електрод в гальванічному елементі виступає як анод, він має негативний заряд. (При електролізі анод заряджений позитивно.)
і катодом, де проходить реакція відновлення, а саме:
![]()
Гальванічний елемент характеризується такими показниками як електрорушійна сила (ЕРС), напруга, ємність й енергія, яку він може віддати у зовнішнє електричне коло.
Електрорушійна сила - це різниця потенціалів електродів гальванічного елемента, причому від більш додатного значення потенціалу віднімають більш від ’мне, Одиниця виміру ЕРС - вольт (В)
Ємність елемента - це кількість електрики, яку джерело струму віддає при розряді.
Величина цього параметра залежить від кількості наявних в елементі реагентів, їх еквівалентів і ступеня перетворення.
Питомою енергією називають таку, що віднесена до одиниці маси або об ’ему елемента.
Високої питомої енергії можна досягти, якщо елемент має високу ЕРС, низьку поляризацію, незначний електрохімічний еквівалент і високий ступінь перетворення реагентів. Для цього анодами в елементах слугують електроди, виготовлені з оксидів металів (мангану, міді, ртуті, срібла) і хлоридів (міді та свинцю).
- Акумулятори.
Акумулятором називається хімічне джерело струму яке здатне накопичувати електричну енергію і по мірі необхідності віддавати її в зовнішнє електричне коло.
Накопичення в акумуляторі електричної енергії здійснюється при пропуску скрізь нього струму від стороннього джерела електрики. Цей процес називається заряджанням акумулятора, і супроводжується перетворенням електричної енергії в хімічну, і в цьому разі акумулятор сам стає джерелом струму.

![]()

![]()
![]()

![]()
![]()
![]()
![]()
По будові і типу електроліту акумулятори в основному бувають двох типів: кислотні і лужні.
В якості електроліту в кислотних акумуляторах застосовується 25-34% водний розчин сірчаної кислоти (H2SO4), а в лужних акумуляторах - 20% розчин у воді їдкого калі (КОН) з домішками моногідрату літія (20-30г/л).
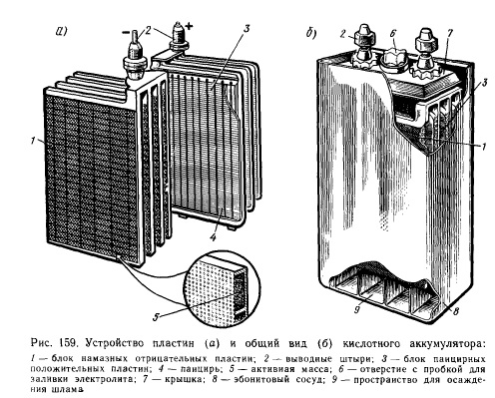
У кислотному акумуляторі в якості електродів застосовують свинцеві пластини, які покривають активними масами, котрі взаємодіють з електролітом при електрохімічних реакціях в процесі заряджання - розряджання. Активною масою позитивного електрода (анода) є перекис свинцю РЬО2, а активною масою негативного електрода (катода) - чистий (губчатий) свинець РЬ. Пластини можуть бути поверхневого або намазаного типу.
Намазані пластини мають більшу поверхню торкання з електролітом і добре їм просочуються, що сприяє зменшенню маси і розмірів акумулятора і дозволяє отримувати при розряджанні більший струм. Номінальна напруга кислотного акумулятора - 2,0В.
![]()
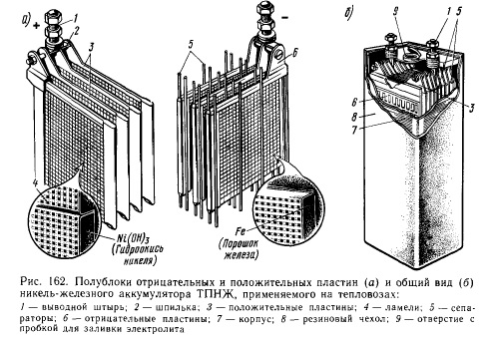
В якості лужних акумуляторів застосовують нікель-залізні та нікель- кадмієві акумулятори. Номінальна напруга всіх лужних акумуляторів - 1,2В.
В нікель-залізних (НЖ) та нікель-кадмієвих (НК) акумуляторах активна маса позитивного електрода в зарядженому стані складається з гідрату окису нікелю NiOH, до якого додають графіт і окис барію. Графіт збільшує електропровідність активної маси а окис барію - строк експлуатації. Активна маса негативного електрода нікель-залізного (НЗ) акумулятора складається з порошкоподібного заліза Fe і його окислів з додаванням серно-кислого нікелю і сірчаного заліза, а нікель-кадмієвого (НК) акумулятора - із суміші порошків кадмію Cd і заліза Fe. Обидва електроди в цих акумуляторах виготовляють у вигляді сталевих нікельованих рамок, в пази яких вставлені наповнені активною масою пакети (ламелі) із нікельованої жесті з великою кількістю дрібних отворів для контакту активної маси з електролітом. В акумуляторах типу НК кожна негативна пластина розташована між двома позитивними пластинами, а в акумуляторах типу НЖ кожна позитивна пластина - між двома негативними. Для запобігання короткого замикання між пластинами встановлюють сепаратори у вигляді ебонітових стрижнів і поліхлорвінілових сіток.
Основними електричними характеристиками акумуляторів являються - ємність, коефіцієнт корисної дії акумулятора, коефіцієнт віддачі акумулятора за ємністю.
За номінальне значення ємності для більшості кислотних та лужних акумуляторів приймають ємність при п’ятигодинному режимі, тобто при розрядженні акумулятора таким током, при якому він розряджається до номінально допустимої кінцевої напруги на протязі 5 годин.
К.к.д.акумулятора називають відношення кількості енергії в кіловатт- годинах, отриманої від нього при розряджанні, до кількості енергії, витраченої на його зарядження.
Коефіцієнтом віддачі акумулятора за ємністю називають відношення кількості електроенергії в ампер-годинах, відданої при розряджанні акумулятора, до кількості електроенергії отриманної при його заряджанні.
В тих випадках коли струм та напруга окремого джерела електроенергії (акумулятора) є недостатніми для нормальної роботи споживача, використовують послідовне, паралельне та змішане з’єднання таких джерел (акумуляторів).
При послідовному з’єднанні акумуляторів негативний електрод першого акумулятора з’єднують з позитивним електродом другого, негативний електрод другого - з позитивним електродом третього і т.д. Споживача під’єднують до позитивного електрода першого і негативного електрода останнього акумулятора.
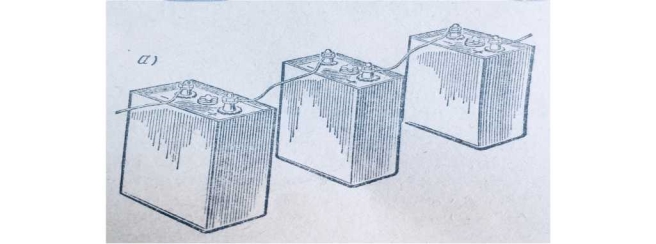
При послідовному з ’єднанні акумуляторів в батарею ЕРС кожного акумулятора згідно Другого закона Кірхгофа додається і загальна ЕРС дорівнює додатку ЕРС окремих акумуляторів. Таким чином чим більше акумуляторів з ’єднано в коло, тим більше напруга під якою знаходиться споживач.
При паралельному з’єднанні всі позитивні електроди окремих акумуляторів з’єднують разом і утворюють загальний позитивний полюс; всі негативні єлектроди окремих акумуляторів також з ’єднують разом і утворюють загальний негативний полюс. Споживача під з’єднують до загальних негативного і позитивного полюсів.
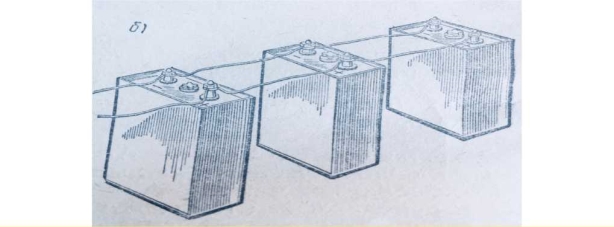
При цьому всі акумулятори будуть знаходитись під однаковою напругою, а загальний струм буде дорівнювати додатку струмів окремих акумуляторів.
![]()
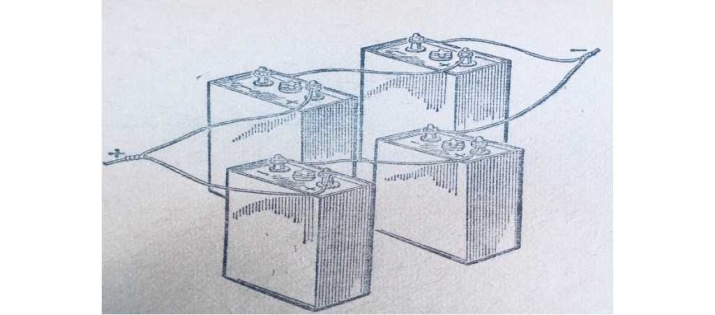
При цьому всі акумулятори будуть знаходитись під однаковою напругою, а загальний струм буде дорівнювати додатку струмів окремих акумуляторів.
ЗАВДАННЯ НА САМОПІДГОТОВКУ
І.Матеріал за конспектом
- Основи Електротехніки для локомотивних бригад, О.Е. Зорохович, С.С.Крилов, Транспорт - 1980 р.
- Що таке акумулятор?
- Які основні характеристики акумуляторів
- Які існують способи з’єднання акумуляторів в батареї?


про публікацію авторської розробки
Додати розробку
