Історія вивчення атома. Ядерна модель атома. Квантові постулати Бора. Досліди Франка і Герца.
________
План-конспект
уроку фізики у 11 класі
Тема уроку: Історія вивчення атома. Ядерна модель атома. Квантові постулати Бора. Досліди Франка і Герца.
Мета уроку: навчальна – ознайомити учнів з історією вивчення атома, ядерною моделлю атома; вивчити постулати Н.Бора
розвивальна – формувати в учнів вміння користуватися науково-популярною літературою та виявлення творчих здібностей при розв’язуванні вправ;
виховна – виховати трудолюбивість, точність і чіткість при відповідях і розв’язуванні завдань та навчити дітей «бачити» фізику навколо себе.
Тип уроку: урок вивчення нового матеріалу
Обладнання: дошка, крейда, мультимедійна презентації та flash-анімації
План уроку
1. Історія вивчення атома
2. Квантові постулати Н.Бора
3. Досліди Д.Франка і Г.Герца
4. Енергетичні стани атомів Гідрогену
5. Розв’язування задач
І. Організаційна частина (привітання, перевірка д/з)
ІІ. Мотивація пізнавальної діяльності
Оголошення теми і мети уроку
ІІІ. Вивчення нового матеріалу (супроводжується навчальною презентацією)
Історія вивчення атома. Відкриття складної будови атома - найважливіший етап становлення сучасної фізики, який позначився на її наступному розвитку. Багато часу та зусиль учених різних країн світу знадобилося, щоб сформувались сучасні уявлення про будову атома. Після перших експериментів можна було робити висновки про складну будову атома і наявність в його структурі електричних зарядів. Ці результати отримано М. Фарадеєм у1833 р. під час вивчення законів електролізу. У 1897 р. Дж. Томсон, вивчаючи електричний розряд у розріджених газах, відкрив електрон. Він виміряв важливу характеристику цієї частинки - питомий заряд е //п = 1,76-10-11 Кл/кг . Американський фізик - Р. Міллікен 1909 р. дуже точно виміряв заряд електрона. Він виявився однаковим у всіх електронів з різних джерел і дорівнював е = -1,6 10~19 Кл. Маса електрона приблизно в 2000 разів менша за масу одного з найлегших атомів - атома Гідрогену - і дорівнює те = 9,1 10~31 кг . Виходячи з цих результатів, Томсон запропонував модель атома, згідно з якою атом є позитивно зарядженою кулею радіусом Д »10~8 см , всередині якої містяться електрони. Таким чином, атом Томсона подібний булочці з родзинками, роль родзинок при цьому виконують електрони.
Однак модель атома Томсона не пояснювала багатьох фізичних явищ. Е. Резерфорд у 1906 р. запропонував планетарну модель атома. Модель була одержана з низки дослідів, які називають дослідами Резерфорда. Резерфорд зондував атоми золота швидкими ядрами Гелію (а-частинками), які вилітали із радіоактивного джерела, вміщеного у свинцевий контейнер.
Навпроти отвору в свинцевому контейнері на екрані, покритому ZnS04, по ходу променя α-частинок, можна було помітити світну пляму. Резерфорд помістив на шляху а-частинок тонку золоту пластинку (фольгу), і помітив, що деякі ядра, проходячи крізь фольгу, відхиляються на значні кути, а незначна їх кількість навіть відбивається назад. Переважна ж більшість ядер, проходила, не помічаючи перешкоди. Узагальнивши результати дослідів, Резерфорд зробив висновки, які і сформували планетарну модель атома.
- В об'ємі атома більшість простору порожня. Майже вся маса атома сконцентрована в дуже малому ядрі (діаметром d - 10~15 м).
- Ядро має позитивний заряд q+, величина якого за модулем дорівнює заряду електрона, помноженому на порядковий номер елементу в таблиці Менделєєва.
- Оскільки атом електрично нейтральний, то позитивний заряд ядра компенсується зарядом електронів, які мають рухатись навколо ядра. Кількість електронів дорівнює порядковому номеру елементу в таблиці Менделєєва.
![]()

Планетарна модель атома змогла пояснити багато спостережень, але одразу ж постали й питання, на які не було відповіді. Дійсно, ядро заряджено позитивно, а електрони - негативно, між ними існує кулонівська сила притягання. Для того, щоб електрони не впали на ядро, вони мусять рухатись навколо нього з доцентровим прискоренням. З теорії Максвелла випливає, що заряд, який рухається з прискоренням, має випромінювати електромагнітні хвилі, втрачаючи енергію, і за розрахунками за час t=10-8 с електрон, рухаючись по спіралі, мусить припинити свій рух. Дослідні ж дані показували, що за нормальних умов атом не випромінює енергії і існує як завгодно довго.
Квантові постулати Бора. Як ми вже зазначали, запропонована Резерфордом модель атома не могла пояснити спектри випромінювання атомів. Вихід із ситуації запропонував датський фізик Нільс Бор у 1913 р. Він прийшов до висновку, що планетарну модель атома Резерфорда слід доповнити ідеями квантової теорії, яка починала утверджуватись. Бор припустив, що електрони в атомах не випромінюють енергію неперервно, випромінювати вони можуть лише під час переходу із одного енергетичного стану в інший. Н. Бор доповнив планетарну модель атома такими постулатами. Атомна система може перебувати тільки в особливих стаціонарних, або квантових, станах, кожному з яких відповідає певна енергія Еп . У стаціонарному стані електрон рухається по коловій орбіті радіусом г і атом енергію не випромінює.
Перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких визначають за формулою ![]() де & і п - цілі числа (номери стаціонарних станів); якщо Ек > Еп фотон з частотою ν випромінюється, якщо Ек<Еп- поглинається.
де & і п - цілі числа (номери стаціонарних станів); якщо Ек > Еп фотон з частотою ν випромінюється, якщо Ек<Еп- поглинається.
Момент імпульсу електрона, що рухається зі швидкістю υn на n-ій орбіті, радіус якої rп, набуває дискретних значень![]()
п = 1, 2, 3,..., т - маса електрона, й - зведена стала Планка.
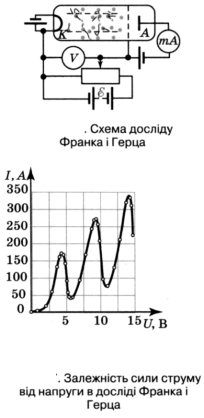 Досліди Д. Франка і Г. Герца. Першими експериментами, що підтвердили теорію Бора, стали досліди, проведені Д. Франком та Г. Герцем у 1913 р. Ідея дослідів була така. Якщо через газ пропускати потік електронів певної енергії, то відбуватимуться зіткнення електронів з атомами, внаслідок чого енергія електронів буде змінюватись. Якщо співудари будуть пружними, то внаслідок того, що маса електронів набагато менша за масу атомів, втрати їх кінетичної енергії будуть незначними. Під час непружного удару, електрон може передати всю свою енергію, або її частину одному з електронів атома. Згідно з законами класичної механіки кількість переданої енергії буде визначатись умовами зіткнення і може набувати довільних значень. Якщо ж стаціонарні стани дійсно існують, то зміни енергії електронів не будуть довільними, - вони будуть дорівнювати різниці значень енергій стаціонарних рівнів атомів.
Досліди Д. Франка і Г. Герца. Першими експериментами, що підтвердили теорію Бора, стали досліди, проведені Д. Франком та Г. Герцем у 1913 р. Ідея дослідів була така. Якщо через газ пропускати потік електронів певної енергії, то відбуватимуться зіткнення електронів з атомами, внаслідок чого енергія електронів буде змінюватись. Якщо співудари будуть пружними, то внаслідок того, що маса електронів набагато менша за масу атомів, втрати їх кінетичної енергії будуть незначними. Під час непружного удару, електрон може передати всю свою енергію, або її частину одному з електронів атома. Згідно з законами класичної механіки кількість переданої енергії буде визначатись умовами зіткнення і може набувати довільних значень. Якщо ж стаціонарні стани дійсно існують, то зміни енергії електронів не будуть довільними, - вони будуть дорівнювати різниці значень енергій стаціонарних рівнів атомів.
Схему досліду наведено на мал.. Скляна колба заповнена парою ртуті (хімічний елемент Меркурій).
Електрони з катода К під дією електричного поля, створеного між електродами джерелом струму прямують до сітки й анода А. Між сіткою й анодом А існує незначна напруга (0,5 В), яка гальмує повільні електрони, перешкоджаючи їх руху до анода.
Результати дослідження залежності сили струму / в колі анода від напруги и показали, що ця залежність має складний нелінійний характер (мал.).
Існування максимумів струму за напруг 4,9;9,8і14,7В можна пояснити лише однією причиною - існуванням в атомі Меркурію стаціонарних станів. Очевидно за напруги V < 4,9 В електрони не встигають набути достатньої енергії і, зіткнувшись з атомами Меркурію, пружно від них відбиваються (адже те < тНg) і легко долають гальмівну напругу між сіткою й анодом. За напруги и = 4,9 В відбувається вже їх непружне зіткнення й електрони втрачають енергію, збуджуючи атоми Меркурію (енергії електрона достатньо для цього). Але, втративши свою енергію, електрони не можуть подолати гальмівну напругу і сила струму в колі анода різко спадає. В міру подальшого зростання напруги між катодом К і сіткою сила анодного струму знову зростає, досягаючи максимуму при 9,8 В. Знову відбуваються непружні зіткнення з передавання енергії від електрона до атома, тобто енергія атома Меркурію змінюється на 4,9 еВ.
![]() Енергетичні стани атомів Гідрогену. Використовуючи закони механіки Ньютона та правила квантування, Бор зумів з високою точністю обчислити енергетичні стани атома Гідрогену.
Енергетичні стани атомів Гідрогену. Використовуючи закони механіки Ньютона та правила квантування, Бор зумів з високою точністю обчислити енергетичні стани атома Гідрогену.
Згідно з постулатами Бора перехід атома з одного стаціонарного стану в інший супроводжується випромінюванням чи поглинанням фотонів, енергію яких визначають за формулою![]() . Частоту випромінювання спектральних ліній атома Гідрогену визначають за формулою Бальмера
. Частоту випромінювання спектральних ліній атома Гідрогену визначають за формулою Бальмера![]() . З порівняння цих формул бачимо, що енергія електрона до і після випромінювання дорівнює
. З порівняння цих формул бачимо, що енергія електрона до і після випромінювання дорівнює![]()
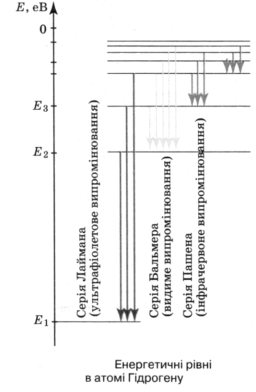 Для наочності прийнято зображати значення енергій атомів у вигляді горизонтальних прямих, розташованих одна над одною на відстані, пропорційній різниці їх енергій. Найнижча пряма відповідає нормальному стану атома.
Для наочності прийнято зображати значення енергій атомів у вигляді горизонтальних прямих, розташованих одна над одною на відстані, пропорційній різниці їх енергій. Найнижча пряма відповідає нормальному стану атома.
На мал. зображено схему рівнів енергії атома Гідрогену.
Енергію електрона, що покинув атом (міститься на нескінченній відстані від ядра) приймають за нуль. Зрозуміло, що в цьому випадку енергія будь-якого електрона, який перебуває ближче до ядра, буде меншою, а отже, від'ємною. У нормальному (не збудженому) стані енергія атома буде мінімальною і у випадку атома Гідрогену її значення Е1 = -13,55 еВ. У першому збудженому стані
(другий енергетичний рівень) атом Гідрогену матиме енергію Е2 = -3,38 еВ, у другому - Е3 = -1,5 еВ.
З основного стану у збуджений атом може перейти, діставши ззовні у будь-який спосіб (наприклад, поглинувши фотон чи зіткнувшись з іншим атомом) порцію енергії, яка дорівнює різниці енергії стаціонарних рівнів. Так, у випадку Гідрогену атом може перейти у збуджений стан, поглинувши енергію: Е2-Е1 = 10,17 еВ, або Е3-Е1 = 12,05 еВ і т.д.
У збудженому стані електрон не може перебувати тривалий час. Під час переходів на перший рівень (п = 1) з другого, третього і т.д. випромінюється ультрафіолетове випромінювання (серія Лаймана), під час переходів на другий рівень з вищих рівнів - випромінювання оптичного діапазону (серія Бальмера) і під час переходів на третій рівень - інфрачервоне випромінювання (серія Пашена). Серії названо на честь вчених, які їх відкрили.
Дайте відповіді на запитання
1. У чому полягала ідея досліду Франка і Герца? Який висновок можна було зробити на основі його результатів?
2. Зобразіть за допомогою схеми енергетичних рівнів атома Гідрогену перехід,
який відповідає випромінюванню ультрафіолетових променів.
- За яким принципом спектральні лінії Гідрогену об'єднано у сери?
- Чи можуть фотони, утворені при випромінюванні атома Гідрогену, мати однакові імпульси, якщо їх енергії різні?
Розв’язуємо задачі



ІV. Підсумок уроку.
V. Домашнє завдання: опрацюватии § 70, 71 ст. 267-272 , дати в-ді на питання після параграфа? Виконати впр. №35(1-3)
1


про публікацію авторської розробки
Додати розробку
