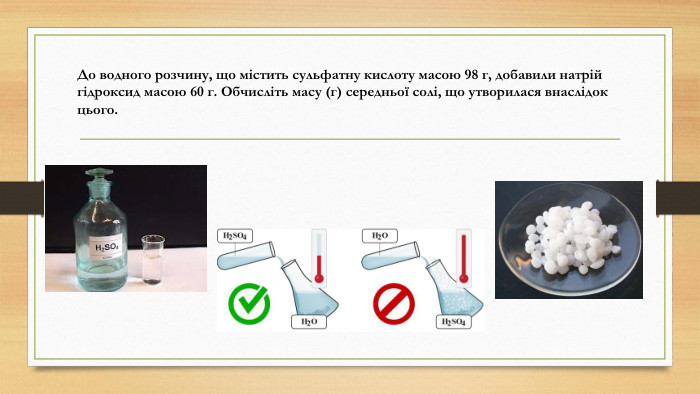
Кислоти (НМТ 2024) Хімія
Про матеріал
Кисло́ти, у класичному визначенні — електроліти, які при розчиненні в йонізуючому розчиннику (наприклад, у воді), дисоціюють з утворенням іонів водню (або протона Н+), таким чином знижуючи кислотність розчину до величини менше ніж pH 7,0.
У сучасній хімії зазвичай використовується інше, хоча й подібне визначення Брьонстеда і Лоурі, за яким кислоти означаються як хімічні сполуки, що є донорами протонів і приймають електрони для утворення іонних зв'язків. Кислоти вступають у реакції з основами, утворюючи солі, а також діють як розчинники. Сильні кислоти корозійні, розбавлені кислоти мають кислий або гострий смак, хоча в деяких органічних кислотах цей смак частково схований за іншими смаковими характеристиками. Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку