Конспект узагальнюючого і контролюючого міжпредметного семінару з біології та хімії на тему «Білки»
Конспект узагальнюючого і контролюючого міжпредметного семінару з біології та хімії для учнів 10 класу на тему «Білки»
Вчитель хімії і біології
Верхньогусненського
ЗЗСО І-ІІІ ступенів
Самбірського району
Львівської області
Ловас Лариса Михайлівна
Тема урок: Білки
Мета уроку:
навчальна: формувати міжпредметні знання про природні полімери-білки як основу всього живого на основі інтеграції знань; формувати цілісне уявлення про навколишній світ;
виховна: формувати уміння встановлювати причинно-наслідкові зв’язки, узагальнюючи та розширюючи уявлення учнів про залежність хімічних властивостей і біологічної функції білків від їх складу та структури;
розвиваюча: розвивати пізнавальну активність, творчу самостійність у навчанні.
Тип уроку: Узагальнення та систематизація знань.
Форма заняття. Узагальнюючий і контролюючий міжпредметний семінар.
Обладнання. Таблиці: «Структура білка», «Схема будови білка кератину», «Органи травлення людини», інструкції щодо проведення кольорових реакцій на білки, комп’ютер, мультимедійна дошка.
Хід уроку
І. Організаційний момент. /1хв\
ІІ. Актуалізація опорних знань учнів. /8хв\
ІІІ. Мотивація теми і мети уроку. /3хв\
IV. Засвоєння нових знань. /20хв\
V. Підсумок уроку. /10хв\
VI. Домашнє завдання. /3хв\
План уроку
- Значення білків для життєдіяльності організмів.
- Склад та будова білків.
- Властивості білків.
- Перетворення білків їжі в організмі людини.
- Успіхи у вивченні будови та синтезу білків.
- Біосинтез білків.
Щоб з’ясувати значення білків для життєдіяльності організмів, учитель-біолог проводить фронтальну бесіду, під час якої докладно розглядаються пластична, опорна, каталітична, регуляторна та захисна функції білків.
У бесіду вступає викладач хімії з питанням: «Чому білки посідають особливе місце в реалізації життєвих процесів?» та «У чому полягає причина здатності білків виконувати різноманітні та складні функції?». Учні висловлюють думку про зумовленість функціональних особливостей білків, їх хімічним складом та будовою.
Далі уточнюють дані про склад білків, вміст у них Карбону (50-55%), Оксигену (21-23%), Гідрогену (6-7%), Сульфуру (0,3-2,5%), Нітрогену (15-18%), Фосфору (0,1-2%) та ін. елементів.
Щоб з’ясувати особливість будови білків учням пропонують запитання.
- Яка хімічна будова білка?
- Чим відрізняються білки від інших природніх полімерів?
- Що є мономерними ланками білка?
- Які амінокислоти ви знаєте?
- Які функціональні групи можуть містити амінокислоти?
- Завдяки чому можлива взаємодія амінокислот між собою?
- За рахунок яких зв’язків утворюється поліпептидний ланцюг?
Відповідаючи на питання, учні зображають загальну формулу амінокислот, формули деяких амінокислот, що містять різні функціональні групи, записують рівняння реакції утворення трипептиду гліцин-аланін-цистеїн, виділяючи пептидні зв’язки та називаючи тип цієї реакції.
Учні роблять висновок, що завдяки амфотерності амінокислоти можуть з’єднуватися у поліпептидний ланцюг у різній послідовності, залишки кожної амінокислоти можуть входити до складу макромолекули багаторазово і що саме це зумовлює можливість існування великої кількості білків. У природі існує лише незначна частина теоретично можливої кількості білків.
Далі один з учнів, використовуючи відповідну таблицю, докладно розглядає різні рівні організації структури білків, пояснює, які зв’язки беруть участь в утворенні первинної, вторинної, третинної структури. При чому первинна структура визначає специфічність білків, а вторинна і третинна зумовлюють функціональну активність білків. Для унаочнення розповіді учень може використати спіральний дріт від телефонної слухавки.
Витягнутий дріт- це модель поліпептидного ланцюга, закручений у спіраль дріт- це модель вторинної структури, спіраль закручена у клубок, дає уявлення про третинну структуру білків.
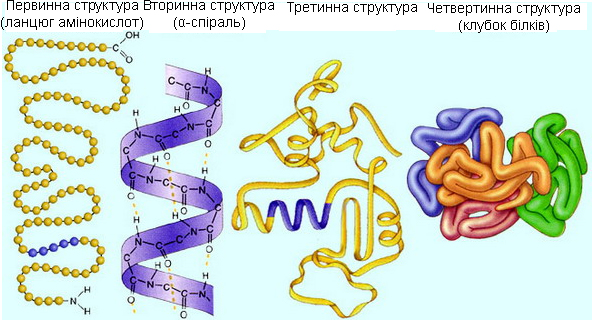
Структурна організація білкової молекули
З класом обговорюється як саме утворюються водневі зв’язки, дисульфідні, складно-ефірні та сольові містки. Учитель нагадує про існування моноамінокарбонових та диамінокарбонових амінокислот. Учні розповідають про четвертинну структуру гемоглобіну та хлорофілу, порівнюючи їх будову та функції, виступають з повідомленням про такі білки як - кератин (вовна, волосся), що має складчасту будову та – кератин (шовк). Пояснюють, чому шовк гладенький на дотик, чому волосинки здатні скручуватися та розтягуватися що відбувається при хімічному завиванні волосся і як зробити його пухнастим і блискучим.
Висновок про важливість певної структури для нормального функціонування білків ілюструють на ліпазі-ферменті підшлункової залози, що починає процес розщеплення нейтральних жирів у тонкому кишечнику. Учні наводять приклади білків простої будови, що мають вигляд поліпептидних ланцюгів (окситоцин, вазопресин, інсулін та ін.).
Підсумовуючи обговорення будови білків, учитель підкреслює, що визначальною для функціонування білкової молекули є первинна структура, наводить приклади: серповидна анемія - захворювання, що виникає в результаті порушення будови поліпептидного ланцюга, при заміні лише одного з 274 амінокислотних залишків змінюється розчинність гемоглобіну, що призводить до зміни форми еритроцитів і порівняно швидкого розпаду їх у селезінці.
Далі обговорюються властивості білків, виходячи з їх будови як біополімерів. Учні пояснюють, чому білки мають різні молекулярні маси, розчинність, що відбувається під час денатурації білків, відмічають практичні значення даного процесу для виготовленні реакції білків, що є наслідком їх високої реакційної здатності, розв’язують такі експериментальні задачі.
- Довести, що до складу білка курячого яйця входять фенілаланін, а в желатині його немає.
- Довести, що до складу овальбуміну входить цистеїн.
Учні проводять лабораторні досліди, роблять висновок. Далі розглядають хімічні властивості: здатність гідролізуватися. Наголошують, що при цьому порушується первинна структура, а отже специфічність білка. Вчитель біології нагадує, про процеси розкладу білків в організмі.
Учитель біології наголошує, що проблема забезпечення людства їжею ще не розв’язана, нагадує страшну статистику наслідків голодомору в Україні. Основним джерелом білків є білки тваринного і рослинного походження. З повідомленням про незамінні амінокислоти та особливості харчування різних народів виступає один з учнів, а інший зацікавлює розповіддю про українські національні страви з м’яса.
Учитель хімії: вивчення структури білків має не тільки теоретичні знання, а й практичні, бо в перспективі дає можливість забезпечувати людство їжею .
Вчені інституту мікробіології та вірусології одними з перших у світі розробили способи добування як окремих амінокислот, так і білкової маси як цінної харчової добавки до раціону худоби.
Звертається увага учнів на природоохоронний аспект цих розробок. Мікробіологічний синтез не тільки забезпечує добування цінних білків, а й утилізує відходи нафтохімічної та паперово- целюлозної промисловості, дає змогу зберегти довкілля.
Один з учнів розповідає як саме синтез білків відбувається в нашому організмі, тобто про біосинтез білків. Використовується таблиця та динамічна модель синтезу білка.
Останній етап семінару - це контрольна робота у вигляді тестового диктанту, що складається з 10 запитань з кількома варіантами відповідей. Після диктанту учні взаємоперевіряють роботи.
Підсумок. Учитель разом з учнями наголошує на залежності властивостей та функцій білків від їх будови, підкреслює незаперечно важливу роль білків у життєдіяльності організмів.
1. Синтез білка здійснюється в органоїді клітини:
а) лізосомі
б) рибосомі
в) хромосомі
г) центросомі
2. Мономерами білка є:
а) амінокислоти
б) моносахариди
в) нуклеотиди
г) пептиди
3. Вторинну структуру білка підтримують зв’язки:
а) водневі
б) гідрофобні
в) ковалентні
4. Під час утворення білкового полімера відбувається зчеплення амінокислот і виділяється речовина:
а) аміак
б) вода
в) оксид вуглецю
г) вуглеводень
5. Амінокислоти відрізняються одна від одної хімічною будовою:
а) аміногрупи
б) карбоксилу
в) радикалу
г) радикалу і карбоксилу
д) карбоксилу і аміногрупи
6. Денатурацією білка називають порушення:
а) тільки його третинної структури
б) тільки вторинної структури
в) вторинної або третинної структури
г) первинної структури
7. Назвіть функцію білків:
а) транспортують амінокислоти до місця синтезу білків
б) беруть участь у хімічних реакціях як ферменти
в) як перинний продукт фотосинтезу ідуть на побудову складніших органічних з’єднань
г) входять до складу клітинних мембран, перешкоджають змішуванню окремих частин клітин між собою
8. Білок, що міститься в червоних кров’яних клітинах:
а) гемоглобін
б) альбумін
в)інсулін
9. Хімічний елемент, що входить до складу амінокислот:
а) нітроген
б) фосфор
в) купрум
10. специфічність білків визначає їх:
а) первинна структура
б) вторинна структура
в) первинна і вторинна структура.
Інструкція
по техніці безпеки до лабораторної роботи на тему
«Кольорові реакції білків»
- Будьте обережні з лугами: луги діють на шкіру і слизові оболонки.
- Набирайте луги гумовою грушею. Переливайте над запасною посудиною.
- Будьте обережні з кислотами, пари яких подразнюють слизові оболонки, дихальні шляхи, очі, викликають опіки шкіри.
- Кислоти набирайте піпеткою.
- Спиртівку запалюйте від запаленого сірника.


про публікацію авторської розробки
Додати розробку
