Ковалентний зв’язок. Речовини молекулярної та атомної будови
Про матеріал
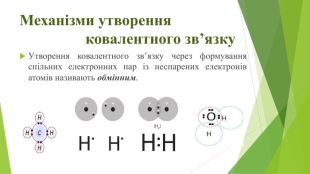
Презентація з хімії для 11 класу на тему:"Ковалентний зв’язок. Речовини молекулярної та атомної будови ". Розглянуті питання механізму утворення ковалентного зв’язку та будова речовин з ковалентним зв’язком. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку