Опорний конспект з теми " Атомна фізика. Будова атома. Теорія Бора "
Конспект лекцій по темі: Будова атома. Теорія Бора.
План
1. Модель атома Томсона. Досліди Резерфорда. Планетарна модель атома.
2.Закономірності в атомних спектрах водню. Квантові постулати Бора.
3.Поняття про квантову механіку. Лазери.
1.Відкриття, зроблені в другій половині XIXст., змусили поступово взяти під сумнів слушність уявлення про атоми як неподільні частинки (атом в перекладі з грецької означає неподільний). Німецькі учені Г.Кірхгоф і Р.Бунзен встановили: кожному хімічному елементу відповідає характерний, властивий лише цьому елементу, лінійчастий спектр випромінювання і поглинання. Тобто світло випромінюється і поглинається окремими атомами, а атом – це складна система, здатна взаємодіяти з електромагнітним полем.

У 1897р. Дж.Томсон відкрив електрон, а в 1898р. запропонував першу модель атома у вигляді позитивно зарядженої кульки радіусом порядку
10-10м, в яку вкраплено окремі електрони, що нейтралізують позитивний заряд (кекс з родзинками).
У 1911р. Е.Резерфорд провів ряд дослідів, пропускаючи крізь тонку металеву фольгу (10-6м) пучок швидких α-частинок. Більшість α-частинок злегка розсіювалися на невеликі кути, проте окремі (одна з 20 000) поверталися назад.
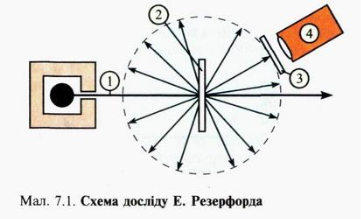 1.пучок α-частинок
1.пучок α-частинок
2. металева фольга
3.люмінісцентний екран
4. мікроскоп
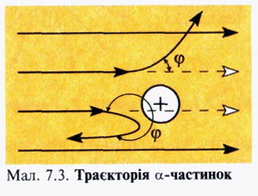
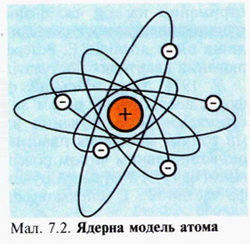
Проаналізувавши результати, Резерфорд запропонував «планетарну» модель атома: атом має вигляд мініатюрної Сонячної системи – весь позитивний заряд і майже вся маса атома (99,4%) зосереджені в атомному ядрі розмір якого має порядок 10-15м, навколо ядра по колових орбітах рухаються електрони, сумарний заряд яких по модулю дорівнює заряду ядра. Розмір атома має порядок 10-10м.
Модель Резерфорда не пояснила спектральних закономірностей і суперечила законам класичної механіки і електродинаміки.
2. Частоту будь-якої лінії в спектрі атома Гідрогену можна подати у вигляді: 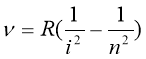 , де R=3,3∙1015с-1, i=1,2,3… n=2,3,4… n> i
, де R=3,3∙1015с-1, i=1,2,3… n=2,3,4… n> i
Ця формула є емпіричною. Пояснити лінійчастий спектр вдалося лише після створення 1913р Н.Бором квантової теорії будови атома, яка базується на таких постулатах:
- Електрони можуть рухатися в атомі тільки по певних стаціонарних орбітах, яким відповідає певна енергія і які визначаються умовою
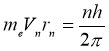 , не випромінюючи при цьому, де n=1,2,3…
, не випромінюючи при цьому, де n=1,2,3…
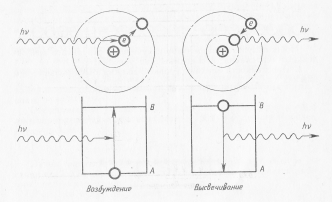
- Атом випромінює або поглинає квант електромагнітної енергії при переході з одного стаціонарного стану в інший. Енергія кванта дорівнює різниці енергій стаціонарних станів електрона до і після переходу:
hν = E2 – E1
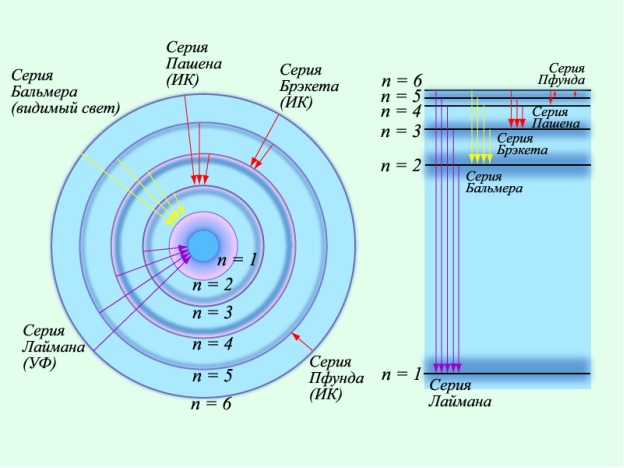
 Радіуси орбіт електрона в атомі водню пропорційні n2:
Радіуси орбіт електрона в атомі водню пропорційні n2:
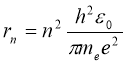 і при n=1 маємо значення першого борівського радіуса: r1 = 0,528∙10-10м. rn=n2∙ r1
і при n=1 маємо значення першого борівського радіуса: r1 = 0,528∙10-10м. rn=n2∙ r1
Швидкість руху електрона на орбіті обернено пропорційна n:
![]() і при n=1 маємо значення швидкості електрона на першій орбіті: V1= 2,2∙106м/с.
і при n=1 маємо значення швидкості електрона на першій орбіті: V1= 2,2∙106м/с. ![]()
Повна енергія атома En на n-му рівні обернено пропорційна n2: ![]() і при n=1 маємо значення Е1= -13,6еВ
і при n=1 маємо значення Е1= -13,6еВ ![]()
3. Теорія Бора була проміжною ланкою між класичною і квантовою фізикою.
У 1923р. Луї де Бройль, проводячи аналогію між квантом, який має енергію Е = hν, та імпульс p = h/λ, припустив, що рух електрона або будь-якої іншої частинки, яка має масу спокою, пов’язаний із хвильовим процесом, якому відповідає хвиля (хвиля де Бройля), довжина якої: ![]() .
.
Тобто стаціонарними є лише ті орбіти, на яких вкладається ціле число довжин хвиль де Бройля.
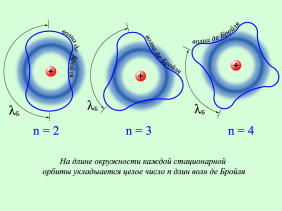 Ідеї де Бройля були поштовхом до створення принципово нової теорії, яка описує поводження мікрочастинок з урахуванням їх хвильових властивостей. Цією теорією стала квантова механіка, основи якої створили в 1925-1926рр. В.Гейзенберг і Е.Шредінгер.
Ідеї де Бройля були поштовхом до створення принципово нової теорії, яка описує поводження мікрочастинок з урахуванням їх хвильових властивостей. Цією теорією стала квантова механіка, основи якої створили в 1925-1926рр. В.Гейзенберг і Е.Шредінгер.
Оскільки частинка має корпускулярно-хвильовий дуалізм, то одночасно точно визначити координату x та імпульс px не можна: чим точніше визначено координату, тим менш точно визначено імпульс і навпаки.
Це випливає з принципу невизначеності Гейзенберга: ![]()
Сам акт спостереження частинки мікросвіту вносить невизначеність.
Характерна особливість квантової механіки – ймовірнісне трактування явищ мікросвіту. Електрон за сучасними уявленнями не кулька, а хмара. Його стан в атомі характеризується чотирма квантовими числами: n, l, m,s. Два електрони в атомі не можуть мати однакові набори квантових чисел – принцип Паулі.
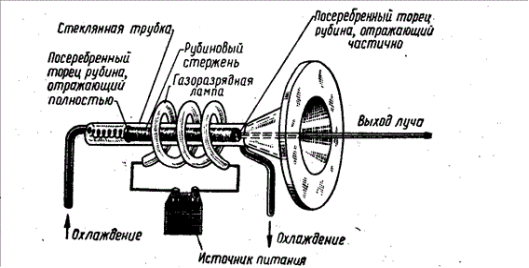
Квантові генератори (лазери, мазери)– це джерела когерентного електромагнітного випромінювання з точно певною частотою і високою напрямленістю. Їх застосовують для зв’язку в космосі, випаровування чи зварювання матеріалів у вакуумі, в хірургічних операціях, в косметології, для збудження хімічних реакцій, здійснення керованої термоядерної реакції та ін.
Принцип дії рубінового лазера
Контрольні запитання по темі: Будова атома. Теорія Бора
- Опишіть дослід Резерфорда і планетарну модель атома.
- Запишіть і поясніть емпіричну формулу для знаходження частоти будь-якої лінії в спектрі атома Гідрогену.
- Сформулюйте і поясніть постулати теорії Бора.
- Які фізичні величини для електрона в атомі водню дозволяє визначити теорія Бора?
- Що таке хвиля де Бройля? Як знайти її довжину?
- Що вивчає квантова механіка?
- Запишіть і поясніть принцип невизначеності Гейзенберга.


про публікацію авторської розробки
Додати розробку
