Органічна хімія НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
У цій презентації представлено загальне уявлення про нітрогеновмісні органічні сполуки, їх будову та реакційну здатність. Обговорюються основні типи реакцій, яким зазнають ці сполуки, а також механізми, за допомогою яких вони відбуваються. Також підкреслюється важливість азотовмісних органічних сполук у різних галузях, таких як медицина та сільське господарство.
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
НІТРОГЕНОВМІСНІ ОРГАНІЧНІ СПОЛУКИ
КЛАСИФІКАЦІЯ
|
Клас |
Загальна формула |
Функціональна група |
|
Нітросполуки |
R—NO2 |
—NO2 |
|
Аміни |
R—NH2 |
—NH2 |
|
Амінокислоти |
NH2—R—CООН |
—NH2 —COOH |
|
Білки |
|
Сполуки зі змішаними функціями |
|
Нуклеїнові кислоти |
|
Сполуки зі змішаними функціями |
1. НІТРОСПОЛУКИ
Нітросполуки – це органічні сполуки, які складаються з карбонового ланцюга сполученого з функціональною нітрогрупою —NO2 .
Наприклад, СН3 — NO2, нітрометан. Одержують реакцією нітрування: 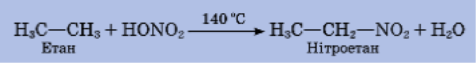

Нітросполуки застосовують як розчинники синтетичних смол і каучуків, вони входять до складу реактивного палива. Нітробензен С6Н5 – NO2 — важливий промисловий продукт, сировина для добування барвників. 2,4,6-тринітротолуен (тротил) — одна з найпоширеніших вибухових речовин.
!!! Нітросполуки — отруйні речовини, вони діють на центральну нервову систему.
ІІ. АМІНИ
Аміни – це органічні сполуки, які містять у своєму складі аміногрупу —NH2. Аміногрупа є функціональною для цього класу сполук. Найпростіший амін це — метиламін (CH3—NH2). Назва «аміни» утворена від назви «амоніак», тому Їх можна також розглядати як похідні амоніаку – NH3, у молекулі якого атоми Гідрогену заміщені на вуглеводневі групи або карбонові ланцюги.
1
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
Класифікація амінів
Залежно від числа заміщених атомів розрізняють первинні, вторинні та третинні аміни:

метиламін диметиламін триметиламін
У всіх амінів, подібно до амоніаку, в атома Нітрогену є вільна електронна пара. ![]()
амоніак метиламін диметиламін триметиламін
Завдяки вільній електронній парі аміни вступають у реакції з водою й кислотами.
Загальна формула насичених амінів: CnH2n+1—NH2 або CnH2n+3N.
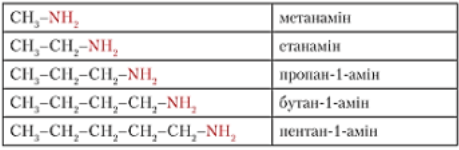
Номенклатура амінів
Правила побудови назви амінів аналогічні таким самим правилам як для спиртів. Назва амінів походить від назви відповідного вуглеводня, при цьому перед назвою вуглеводня ставиться номер атома Карбону, з яким сполучена аміногрупа, і префікс «аміно».
1) обрати найдовший лацюг атомів Карбону;
2) карбоновий ланцюг номерують з того краю, до якого ближче розташована аміногрупа —NH2.
3) назвати алкан;
4) додати суфікс – амін.
Вторинні й третинні аміни симетричної будови прийнято називати так: СН3 – NH – CH3 — метилметанамін;
СН3 – NH – C2H5 — метилетанамін;
СН3 – N – CH3 — диметилметанамін;
ǀ
СН3
2
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ

3-етил-4-метилгексан-1-амін
Поширення у природі. Аміни мають досить обмежене поширення у природі. Метиламін: СН3―NН2 при звичайних умовах – газ 
(tпл.=-92,50С; tкип.=-6,50С); має різкий запах, подібний до
запаху аміаку; добре розчиняється у воді і органічних
розчинниках. Метиламін виявлено у розсолі для
маринування оселедців, а також у деяких рослинах,
наприклад, у проліску багаторічному – рослині сімейства
молочайних. У промисловості метиламін отримують при нагріванні метаналю з амоній хлоридом:
2CH2O + NH4Cl = [CH3NH3]Cl + HCOOH
Метиламін використовують при виробництві барвників і лікарських препаратів. Диметиламін: СН3―NН―СН3 при звичайних умовах – безбарвний газ (tпл.=- 92,20С; tкип.=-6,90С); при великих концентраціях має різкий запах, подібний до запаху амоніаку; добре розчиняється у воді і органічних розчинниках. В природі дииметиламін зустрічається як продукт гниття білків. У промисловості диметиламін отримують при нагіванні метаналю з метиламоній хлоридом:
2CH2O + [CH3NH3]Cl = [(CH3)2NH2]Cl + HCOOH
Диметиламін використовують в органічному 
синтезі, виробництві лікарських препаратів, ракентого
палива.
Диметиламін (СН3)2NН і триметиламін (СН3)3N
виявлено у розсолі для маринування оселедців. Власне
триметиламін і надає оселедцям добре відомий
характерний запах.
Триметиламін: N(СН3)3 при звичайних умовах – це 
безбарвний газ (tпл.=-117,10С; tкип.=2,90С); при великих
концентраціях має різкий запах, подібний до запаху амоніаку,
а при малих концентраціях – дуже неприємний запах;
розчиняється у воді і органічних розчинниках. Також
триметиламін входить до складу деяких рослин, наприклад,
одного з видів глоду. У промисловості триметиламін добувають при нагіванні метанолу з амоніаком у присутності каталізатора (Al2O3):
3
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
3CH3OН + NH3 = (CH3)3N + 3H2O.
Триметиламін використовують в органічному синтезі та виробництві кормових добавок.
1,4-бутандиамін Н2N−(СН2)4−NН2 і 1,5-пентандиамін Н2N−(СН2)5−NН2 у вигляді солей виявлено у пиві.
У вільному стані вказані аміни утворюються при гнитті білків і зумовлюють так званий трупний запах. Як 1,4-бутандиамін (путресцин), так і 1,5-пентандиамін (кадаверин) токсичні. Зазвичай у природних умовах аміни утворюються в наслідок гниття білків. Значно більше поширення мають похідні амінів, які виконують в живих організмах різноманітні функції. Серед похідних амінів, що відіграють ключову роль у життєдіяльності організмів – амінокислоти і гетероциклічні аміни, що входять до складу нуклеїнових кислот.
Хімічні властивості амінів
1. Реакції з кислотами. Під час взаємодії амінів з кислотами утворюються солі — йонні сполуки:
СH3 – NH2 + HCl → [CH3NH3]Cl.
метиламін метиламоній хлорид
2. Оснóвні властивості амінів (реакція з водою). Під час розчинення у воді насичені аміни частково реагують з нею:
СН3NН2 + H2O = [СН3NН3]OH = [СН3NН3]+ + OH−.
йон метиламонію
Йони ОН – у водному розчині аміну можна виявити за допомогою індикатора. Аміни є більш слабкими основами, ніж амоніак. Зі збільшенням величини вуглеводневого радикалу основні властивості послаблюються. Ароматичні аміни є більш слабкими основами ніж аліфатичні аміни.
3. Горіння амінів
4CH3NH2 + 9O2 → 4CO2 + 10H2O + 2N2
Анілін або феніламін
Це ароматичний амін з молекулярною формулою С6Н5 – NH2. Його називають феніламін за назвою радикалу —С6Н5 . Анілін при звичайних умовах безбарвна рідина обмежено розчиняється у воді і добре в органічних розчинниках, наприклад: ацетоні, бензені. Анілін є досить токсичним і може проникати в організм людини навіть через шкіру. У промисловості анілін отримують за реакцією Зініна: 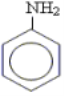

4
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
Анілін 

використовують
для виробництва
барвників,
полімерів,
лікарських
препаратів.
!!! Анілін і його похідні негативно впливають на живі організми, завдають шкоди довкіллю. Про вплив аніліну на здоров’я людини та довкілля можна проаналізувати з піктограм – елементами маркування тари з аніліном: 
ІІІ. АМІНОКИСЛОТИ
Органічні сполуки можуть мати у своєму складі декілька різних функціональних груп. До таких сполук належать вуглеводи, амінокислоти, білки, нуклеїнові кислоти тощо.
Амінокислоти — органічні сполуки, у складі яких є дві функціональні групи: аміногрупа — NН2 і карбоксильна — COOH, з’єднані з вуглеводневим радикалом. Загальна формула амінокислот — NH2 – R – COOH.
Поширення у природі. В природі поширені лише α−амінокислоти, що є структурними елементами білків та інших біологічно активних речовин. Номеклатура амінокислот. Амінокислоти називають так само як і карбонові кислоти вказуючи положення аміногрупи за таким алгоритмом:
Аміно + алкан + ова кислота → аміноалканова кислота
4 3 2 1
Наприклад, NН2 –CH2 – CH2 – СН2 – COOH — це 4-амінобутанова кислота. Для складання назв ізомерів використовують такі правила:
1) прономерувати найдовший карбоновий ланцюг, починаючи з атома Карбону в карбоксильній групі;
5
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
2) перед назвою кислоти позначити цифрою положення аміногрупи та інших замісників в алфавітному порядку;
3) додати назву кислоти із суфіксом – ова та слово кислота. Наприклад: 
В залежності від положення аміногрупи розрізняють α−, β−, γ−амінокислоти, тощо. Найбільш важливе значення мають α−амінокислоти, які входять до складу білків. Загальний вигляд формули α−амінокислоти:
![]()
Положення аміногрупи та інших замісників у головному ланцюгу вказують літерами або цифрами починаючи від карбоксильної групи, як показано на малюнку:
 пентанова кислота або δ – пентанова
пентанова кислота або δ – пентанова

5- аміногептанова кислота або δ – аміногептанова кислота  Приклади амінокислот
Приклади амінокислот
Гліцин – {Gly}(амінооцтова кислота, глікокол) – безбарвні 
кристали (tпл.≈2320С); добре розчиняється у воді; в органічних розчинниках практично не розчиняється. Гліцин найбільш поширена у складі білків амінокислота. В живих клітинах гліцин є вихідною речовиною для синтезу багатьох біологічно активних речовин, наприклад: порфіринів (хлорофіл або гемоглобін) і пуринових основ (нуклеїнові кислоти). Отримують гліцин гідролізом желатину, а використовують у синтезі пептидів.
6
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
Аланін – {Ala} (α−амінопропіонова кислота) – безбарвні 
кристали (tпл.≈3150С); добре розчиняється у воді, в етанолі розчиняється погано.
Аланін в живих організмах знаходиться як у вільному стані, так і входить до складу білків, а також інших біологічно активних речовин, наприклад, вітамін В3. Використовують у синтезі біологічно активних пептидів.
Фенілаланін – {Phe} (2-аміно-3-фенілпропіонова кислота) – 
безбарвні кристали (tпл.≈2800С); обмежено розчиняється у воді, в етанолі розчиняється погано. Фенілаланін входить до складу переважної кількості білків до 3-8%, наприклад, гемоглобіну. Фенілаланін належить до незамінних амінокислот, тобто тих кислот, що не синтезуються в організмі людини.
Одержання α−амінокислот
Амінокислоти одержують гідролізом природних білків; мікробіологічним синтезом; синтезом з галогенозаміщених карбонових кислот:
![]()
Хімічні властивості α−амінокислот
1. Кислотно-оснóвні властивості. Амінокислоти мають амфотерні властивості оскільки містять як основну групу -NH2, так і кислотну групу -СООН. Амфотерність амінокислот зумовлена утворенням внутрішніх солей біполярних йонів: H2N-CH2-COOH → H3N+-CH2-COO−
Тому, амінокислоти реагують і з лугами:
NH2 – CH2 – COOH + NaOH → NH2 – CH2 – COONa + H2О
натрій аміноетаноат
Тому,амінокислоти реагують і з кислотами:
NH2 – CH2 – COOH + HCl → [NH3+ CH2 – COOH]Cl–
Назва цієї солі утворюється подібно до назв амінів: аміноетанова кислота гідрогенхлорид.
7
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
2. Реакції поліконденсації. α−Амінокислоти при взаємодії між собою утворюють аміди, які називають пептидами. Зв'язок – (СО – NH) – називається пептидним:

Наприклад, при взаємодії гліцину і аланіну утворюється дипептид гліцилаланін  Реакції утворення пептидів з амінокислот належать до реакцій поліконденсації.
Реакції утворення пептидів з амінокислот належать до реакцій поліконденсації.
Застосування амінокислот
Амінокислоти необхідні для побудови білків живого організму. Люди і тварини отримують їх із білковою їжею.
✔ Амінокислоти використовують у медицині при захворюваннях крові, внутрішніх органів, нервової системи, порушеннях обміну речовин. Вони знешкоджують токсичні речовини в організмі.
✔ Деякі амінокислоти слугують харчовими добавками у тваринництві. ✔ Із аміногексанової кислоти виготовляють синтетичне волокно капрон. ✔ Амінокислоти використовують у приготування коктейлей для спортивного харчування.
✔ Додавання натрієвої солі глутамінової кислоти (натрій глутамату) надає ряду продуктів м'ясний смак.



 8
8
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
ІV. БІЛКИ
Білки – природні високомолекулярні сполуки, молекули яких складаються із залишків молекул амінокислот, які сполучені один з одним пептидними зв’язками. Білки є полімерами, мономерами яких є амінокислоти. Зазвичай білки містять 100 і більше залишків молекул амінокислот. Більшість білків людського організму містять кілька сотень амінокислотних залишків. Отже, молекулярна маса білків коливається від декількох тисяч до декількох мільйонів.

Класифікація білків. За складом білки поділяють на протеїни — прості білки, що складаються із залишків молекул амінокислот, і протеїди — складні білки, що складаються із залишків молекул амінокислот і різних небілкових речовин, зокрема йонів металічних елементів.
Структура білків

 Застосування білків: харчова промисловість - білки є найважливішим компонентом харчування людини; виробництво лікарських препаратів, виробництво амінокислот.
Застосування білків: харчова промисловість - білки є найважливішим компонентом харчування людини; виробництво лікарських препаратів, виробництво амінокислот.
9
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
Одержання: Звичайно білки отримують з природної сировини. Людина отримує білки з їжею, молоком, тварини — з кормами. За дії ферментів вони розщеплюються на амінокислоти, з яких синтезуються інші білки, властиві певному організму. У рослинах білки утворюються з неорганічних речовин у результаті фотосинтезу:
hν
СО2 + Н2О + деякі розчинені солі → білки + О2 .
Хімічні властивості білків
1. Денатурація – руйнування четвертинної та третинної структури білків під дією хімічних реагентів, нагрівання або радіації.

2. Гідроліз білків. За наявності кислот, лугів або ферментів білки зазнають гідролізу. Кінцеві продукти такого перетворення — амінокислоти, залишки молекул яких містились у складі молекул білка. Гідроліз відбувається в кілька стадій: білок → поліпептиди → дипептиди → амінокислоти
Після потрапляння білкових речовин у шлунок під дією хлоридної кислоти і ферменту пепсину відбувається їх гідроліз. Організм людини засвоює білкові речовини тільки у вигляді суміші амінокислот.

3. Якісні реакції білків. Для виявлення білків або окремих амінокислот у їхньому складі використовують спеціальні якісні реакції, які називають кольоровими реакціями білків.
10
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
✔ біуретова реакція. При взаємодії білків із розчином солі Купрум(ІІ)сульфату в лужному середовищі утворюється фіалкове забарвлення. Це — біуретова реакція, яка є якісною на пептидні групи в молекулах органічних сполук: [−CO −NH−]

✔ ксантопротеїнова реакція. Якщо білки або їхні розчини нагрівати з концентрованою нітратною кислотою, то наявні в білках фрагменти молекул ароматичних амінокислот взаємодіють із цією кислотою з утворенням нітрогеновмісних сполук жовтого кольору. Це саме відбувається при потраплянні нітратної кислоти на шкіру (утворюється жовта пляма, яка не змивається водою).
Дана реакція характеризує наявність бензойних ядер, що входять до складу деяких амінокислот, наприклад, фенілаланіну:


V. НУКЛЕЇНОВІ КИСЛОТИ
Нуклеїнові кислоти – високомолекулярні природні полімери, які є продуктами поліконденсації ортофосфатної кислоти з пентозами, що вміщують радикали гетероциклічних амінів.
11
ЛЕКЦІЇ З ОРГАНІЧНОЇ ХІМІЇ
Поширення у природі. Нуклеїнові кислоти і білки складають основу життєдіяльності будь-якого організму. Молекули ДНК і РНК відіграють основну роль в життєдіяльності біологічних систем. ДНК виконує роль порталу, що вміщує інформацію про структуру білків, а РНК виступає як дієвий чинник синтезу білків
відповідно до структури ДНК.

Хімічна будова. Гетероциклічні аміни, що входять до нуклеїнових кислот є похідними пурину і піримідину, тому відповідно називаються пуриновими і піримідиновими основами

До складу ДНК входять аденін, гуанін, цитозін і тимін. До складу РНК входять аденін, гуанін, цитозін і урацил. Урацил – це диметильований тимін: 
ДНК знаходиться у ядрах клітин та існує у вигляді подвійної спіралі. Будова молекули РНК подібна до ДНК, але замість дезоксирибози РНК вміщує рибозу, а замість тиміну – урацил.
12


про публікацію авторської розробки
Додати розробку
