Основи біоорганічної хімії (навчальний посібник)
Олександрійська міська рада
Управління освіти, молоді та спорту
Науково-методичний центр
НВК «Ліцей інформаційних технологій-
спеціалізована школа ІІ ст.»
С. Орлова
Основи біоорганічної хімії
 Навчальний посібник
Навчальний посібник
Орлова С.В. Основи біоорганічної хімії. Навчальний посібник/Орлова Світлана Вікторівна. – Олександрія, 2018. – 48 с.
Пропонований посібник вміщує тези, таблиці, визначення понять з навчальних тем курсу біоорганічної хімії для учнів хіміко – біологічних класів, а також ряд завдань, які можуть бути використані як на уроці для узагальнення знань з теми, так і для підготовки домашнього завдання. Також у посібнику є орієнтовні лабораторні та практична роботи.
Посібник рекомендовано використовувати на заняттях курсу за вибором «Основи біоорганічної хімії», органічної хімії та на уроках біології.
Розглянуто та затверджено на засіданні ради науково-методичного центру управління освіти, молоді та спорту Олександрійської міської ради (протокол №___________ від _______________)
ЗМІСТ
І. Теоретичні основи як підґрунтя для укладання навчального посібника
2.1 Класифікація органічних сполук
2.2 Номенклатура органічних речовин
2.3 Характеристичні групи, відповідні префікси та суфікси
2.5 Хімічні реакції органічних сполук
2.6 Завдання для корекції знань
ІІІ. Карбонові кислоти. Ліпіди
3.1 Функціональні похідні карбонових кислот
3.3 Завдання для корекції знань
4.2 Хімічні властивості амінокислот:
4.3 Завдання для корекції знань:
5.2 Завдання для корекції знань
VI. Біологічно активні гетероциклічні сполуки. Нуклеотиди, нуклеозиди, нуклеїнові кислоти
6.1 Завдання для корекції знань
Вступ
Школи (класи) з поглибленим вивченням хімії – одна з форм диференціації навчання, що покликана розвивати в учнів здібності до хімії, формувати ключові та предметні компетентності, стійкий інтерес до предмета і тим самим створювати основу для свідомого вибору майбутньої професії, пов’язаної з використанням хімічних знань. Навчання в класах із поглибленим вивченням хімії служить загальній меті сучасної школи: розвитку здібностей учнів, підвищенню престижу інтелекту, формуванню високоморальної громадянської позиції та національної свідомості, готовності до праці. Учні поглиблено вивчають хімію з орієнтацією на підготовку до здобуття вищої хімічної, медичної, біологічної, технологічної освіти, масової робітничої професії хімічного профілю. Отже, завдання цього курсу полягає в тім, щоб забезпечити поглиблену допрофесійну підготовку випускників, які бажають у майбутньому набути спеціальність, пов’язану з використанням хімічних знань [6].
Одним із шляхів диференціації та індивідуалізації навчання є впровадження в шкільну практику системи курсів за вибором та факультативів, які реалізуються за рахунок варіативного компонента змісту освіти і доповнюють та поглиблюють зміст навчального предмета. Вивчення курсу за вибором «Основи біоорганічної хімії» дозволить учням з’ясувати закономірності будови й реакцій окремих класів карбонових сполук у зв’язку з їх біохімічними функціями та впливом на фізіологічні процеси, які відбуваються у біологічних системах, виявити хімічні основи функціонування молекул, що складають живу клітину. Біоорганічна хімія нерозривно пов’язана та є пропедевтичною дисципліною в оволодінні закономірностями біологічної хімії та молекулярної біології – наук, що вивчають хімічний склад живих організмів, властивості та механізми перетворення молекул, які входять до їх складу [8].
Даний посібник було укладено до авторської програми курсу за вибором «Основи біоорганічної хімії» для 11 класу з поглибленим вивченням хімії та біології Орлової С.В. (Лист ПТЗО від 17.02.2014 №14.1/12 – Г – 135)
Мета посібника – акцентувати увагу на основних поняттях і термінах біоорганічної хімії, упорядкувати відповідно до програми лабораторні та практичну роботи, дібрати різноманітні завдання, які можна було б використовувати для підсумкового коригування знань.
Оскільки об’єм посібника обмежено, провідна ідея посібника полягає в створенні системи головних тез, яка дає можливість оптимально активізувати пізнавальну діяльність учнів.
Актуальність проблеми визначена тим, що в освітньому процесі заклади загальної середньої освіти можуть використовувати лише навчальну літературу, що має гриф МОН України або яка схвалена відповідною комісією Науково-методичної ради з питань освіти Міністерства освіти і науки України. Але відповідно до даної програми курсу за вибором, відповідного підручника не укладено. За основу було взято декілька посібників для ВНЗ та підручник «Основи біоорганічної хімії» для 11 класу середньої загальноосвітньої школи з поглибленим вивченням хімії Пивоваренко В.Г. [5]
При доборі навчального матеріалу і формуванні структури посібника було враховано, що теоретичною базою біоорганічної хімії є органічна хімія, основами знань з якої учні оволодівають у 9-10 класах відповідно до чинного Державного стандарту базової і повної загальної середньої освіти.
І. Теоретичні основи як підґрунтя для укладання навчального посібника
Соціально-економічні зміни, що відбуваються в суспільстві, позначилися протиріччям між сучасними вимогами до якості засвоєння певних знань, умінь та реальною освітньою практикою природничо-математичної підготовки учнів загальноосвітньої школи. Якщо ми хочемо дати підростаючому поколінню шанс на успіх, то важливо точно визначити основні знання – фундамент компетенцій, якими повинні оволодіти учні, щоб підготуватися до самостійного життя, або до одержання вищої освіти. Зміст освіти повинен передбачати перетворення раніше засвоєних знань у нові способи діяльності.
Завданням курсів за вибором, зокрема курсу «Основи біоорганічної хімії» є забезпечити поглиблену допрофесійну підготовку випускників, які бажають у майбутньому набути спеціальність, пов’язану з використанням хімічних знань .
Біоорганічна хімія є сучасною фундаментальною наукою, що входить як окрема дисципліна або як частина комплексних дисциплін до навчальних планів медичних та фармацевтичних вищих навчальних закладів та профільних факультетів класичних університетів [8, с.6]
Роль біоорганічної хімії як науки полягає у встановленні хімічних та фізико-хімічних основ функціонування молекул, що складають живу клітину. Виходячи із цього, біоорганічна хімія нерозривно пов’язана та є пропедевтичною дисципліною в оволодінні закономірностями біохімії та молекулярної біології – наук, які вивчають хімічний склад живих організмів, властивості та перетворення молекул, що входять до їхнього складу, й біофізики – науки про фізичні закономірності, що властиві живим системам. Таким чином, успіхи біоорганічної хімії у значній мірі визначають подальший розвиток усього комплексу біомедичних наук, оскільки без знань будови та хімічних перетворень органічних сполук, які беруть участь у метаболізмі, неможливо зрозуміти його суть, розробити методи регуляції таких біологічних явищ як ріст та поділ клітин, генерація мембранного потенціалу, передача нервового імпульсу, м’язове скорочення тощо[8, с.6].
Ефективність навчального процесу значною мірою залежить від активності учнів під час сприймання і засвоєння матеріалу, яка виявляється у напруженій роботі їх уяви, пам’яті, мислення, інтересу до предметів і явищ, що вивчаються.
Із цією метою було вирішено упорядкувати посібник із завданнями з курсу за вибором «Основи біоорганічної хімії». Як було зазначено вище, курс біоорганічної хімії є предметом вивчення вищої школи, тому наразі немає підручника, щоби задовільнив вимоги відповідної програми даного курсу за вибором. Спроби впровадження курсу біоорганічної хімії для вивчення у сере дній загальноосвітній школі були . У підручнику для 11 класу «Основи біоорганічної хімії» автора Пивоваренко В.Г.[5] навчальний матеріал викладається за певною логічною схемою, охоплює основні класи природних сполук, але питання хімічного зв’язку, типів ізомерії не винесено в окрему тему, а подано у контексті вивчення кожного окремого класу органічних сполук. На нашу думку, краще розпочати вивчення основ біоорганічної хімії саме із розгляду класифікації, номенклатури, типів ізомерії та типів хімічних реакцій, характерних для органічних сполук, що надасть правильного уявлення про функціонування таких речовин в живих організмах. У підручнику уживано спрощені зображення хімічних формул органічних сполук, які традиційно використовує вища школа, а також хімічні властивості амінокислот, способи їхнього добування, хімічні властивості вуглеводів, синтез ліпідів подано досить складними для розуміння учнями 11 класу схемами. У даному підручнику добре подано теоретичний матеріал про будову молекул нуклеїнових кислот, структуру білкових молекул, пептидів, низькомолекулярних регуляторів, що супроводжується детальними малюнками та схемами. Після кожного параграфу містяться завдання для узагальнення знань, але їх не завжди достатньо для ґрунтовної перевірки знань, для підбору завдань для тематичного оцінювання, також відсутні завдання у тестовій формі, що наразі є актуально під час підготовки учнів до ЗНО.
Дуже гарно структуровано підручник для студентів-іноземців вищих медичних навчальних закладів ІV рівня акредитації під редакцією Ю.І. Губського[8]. Увагу надано питанням природі хімічного зв’язку, класифікації органічних сполук, подано у вигляді таблиці загальні формули класів, основні характеристичні групи, назви за номенклатурою IUPAC, розкрито коротко, але зрозуміло класифікацію хімічних реакцій. У підручнику міститься словник основних понять й термінів, багато різноманітних завдань як з відкритою відповіддю, так і у тестовому форматі, подано структурні формули органічних речовин. В кінці кожної теми міститься перелік рекомендованих джерел для поглиблення знань. У підручнику містяться лабораторні і практичні роботи із протоколами їх оформлення. Даний підручник був взятий за основу, оскільки дозволу до використання його у загальноосвітній школі немає.
Під час вивчення органічної хімії, біоорганічної та біохімічної хімії необхідно формувати компетентність з номенклатури органічних сполук відповідно до міжнародних стандартів. Навчально-методичний посібник для вчителів та учнів загальноосвітніх навчальних закладів «Сучасна термінологія та номенклатура органічних сполук» авторів Толмачової В.С., Ковтун О.М. та ін. [7] дає вичерпну інформацію з термінології та номенклатури органічних речовин за рекомендацією IUPAC. Окрім цього у даному посібнику розроблено стандартизовані тестові завдання для об’єктивного контроля знань з номенклатури органічних сполук.
Органічна хімія є базою для біоорганічної, тому виникає необхідність у підручнику, де сконцентровано викладені основи даної дисципліни і матеріал скомпоновано так, щоб після його засвоєння учні могли самостійно поглиблювати свої знання та опрацьовувати спеціальну літературу з органічної та біоорганічної хімії. Існує багато підручників для школярів з основ органічної хімії, що мають гриф МОН [3], але оскільки тема «Функціональні похідні карбонових кислот» не вивчається у шкільному курсі органічної хімії, виникла необхідність пошуку інформації у підручниках з органічної хімії для вищих навчальних закладів. Одним з них виявився підручник для студентів вищих навчальних закладів «Органічна хімія» під редакцією Л. Д. Бобрівник, В.М. Руденко, Г.О. Лезенко [1], де доступною мовою стисло викладено визначення, приклади і назви гідроксикислот, оксокислот за трьома номенклатурами, типи ізомерії, характерні для цих речовин, розкрито їхні фізичні і хімічні властивості, подано інформацію про деяких окремих представників та зазначено їхнє застосування.
Механізми реакцій органічних сполук методологічно правильно розкрито у навчальному посібнику професора кафедри загальної хімії Сумського державного університету, доктора хімічних наук Миронович Л.М. «Біоорганічна хімія: Скорочений курс» для студентів медичних спеціальностей вищих навчальних закладів [4]. Також у даному навчальному посібнику стисло, але доступно для розуміння викладено теоретичний матеріал про гетероциклічні сполуки, які мають біологічне значення, оскільки дана тематика входить у коло наукових інтересів автора підручника.
Таким чином, вивчаючи питання доступності навчально-методичної літератури з біоорганічної хімї [2], можна зробити висновок про відсутність посібників, підручників, робочих зошитів, методичних рекомендацій щодо вивчення курсу за вибором «Основи біоорганічної хімії» для учнів 11 класу, що вивчають хімію поглиблено або на профільному рівні. Підручники, які було опрацьовано та пошуки у мережі підтверджують наявність розробок навчальних посібників та підручників насамперед для студентів вищих навчальних закладів. Це дозволяє зробити висновок про доцільність укладання навчального посібника, адаптованого під освітні потреби школярів 11 класу, які бажають вивчати даний курс.
ІІ. Класифікація органічних сполук за будовою карбонового ланцюга та за природою функціональних груп. Номенклатура органічних сполук. Ізомерія. Реакційна здатність біоорганічних сполук. Природа хімічного зв’язку
Біоорганічна хімія вивчає біополімери (білки, полісахариди, нуклеїнові кислоти), біорегулятори (ферменти, гормони, вітаміни), а також синтетичні біологічно активні сполуки (лікарські засоби, ростові речовини та ін.)
До завдань біоорганічної хімії входить вивчення будови й синтезу природних і синтетичних біологічно активних сполук, виявлення залежності між їхньою структурою та біологічною дією, вивчення хімічних перетворень всередині та поза організмом.
Біоорганічна хімія є фундаментальною основою для засвоєння ряду дисциплін, що пов’язані з вивченням процесів життєдіяльності на молекулярному рівні (біохімія, біофізика, біологія, фізіологія та ін.)
Для вивчення біоорганічної хімії необхідно міцне засвоєння основ органічної хімії: сполук Карбону – вуглеводнів та їх похідних.
2.1 Класифікація органічних сполук

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Ациклічні сполуки – сполуки з відкритим ланцюгом.
Насичені містять тільки прості зв’язки:
Карбон – Карбон: СН3 – СН2 - СН2ОН
Ненасичені містять кратні зв’язки:
Карбон – Карбон: СН3 –СН=СН2
Циклічні органічні сполуки містять у своїй структурі замкнуті ланцюги атомів Карбону (цикли). Вони поділяються на аліциклічні та ароматичні.
Системи з замкнутим ланцюгом кон’югації , які відповідають правилу Гюккеля, називають ароматичними.
2.2 Номенклатура органічних речовин
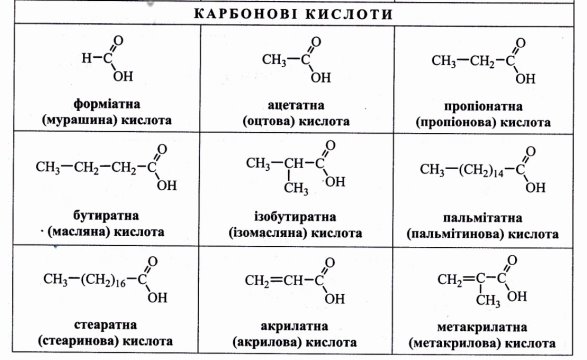
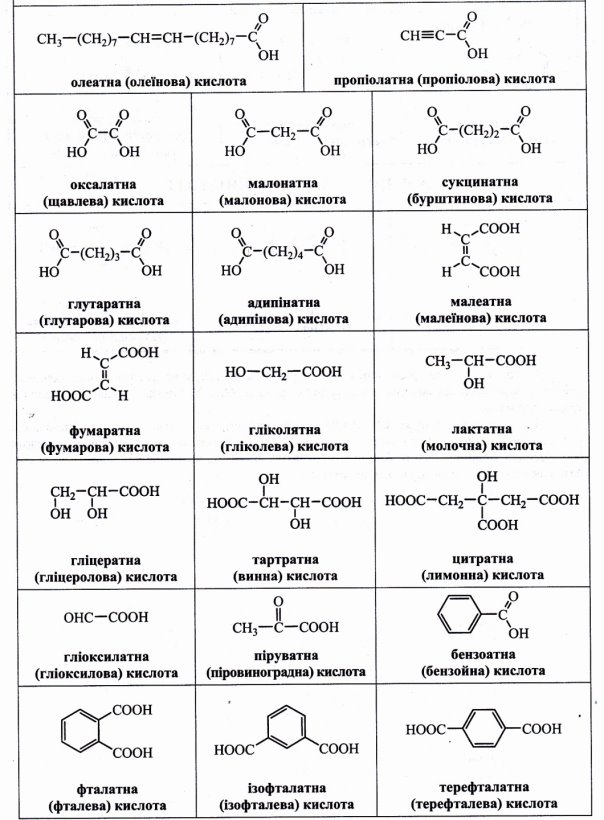
І. Тривіальна номенклатура. Не відображає структуру молекули, а лише деякі властивості, зовнішні ознаки або походження. Це, як правило, випадкові назви, які можуть вказувати на забарвлення, запах, смак, джерело добування або хімічні властивості сполуки. Так, тривіальні назви багатьох карбонових кислот (мурашина, оцтова, молочна, яблучна, лимонна, винна тощо) вказують на джерело, з якого їх було одержано.
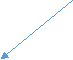
ІІ. Раціональна номенклатура. В основу покладено назви вуглеводнів. Згідно з цією номенклатурою органічні сполуки поділяють на класи, в межах яких, як правило, кожну сполуку розглядають як похідну від першого представника гомологічного ряду. Так, у ряду насичених вуглеводнів усі сполуки розглядали як похідні метану – найпростішого вуглеводню:
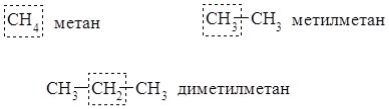
ІІІ. Радикально – функціональна (замісникова). Назва речовини складається з двох елементів – групової назви, що відповідає певній фукціональній групі, і назви вуглеводневого залишку (або кількох залишків), сполучених з цією функціональною групою.
Згідно із замісниковою номенклатурою органічні сполуки розглядають як похідні вуглеводнів. Основними правилами утворення назви є:
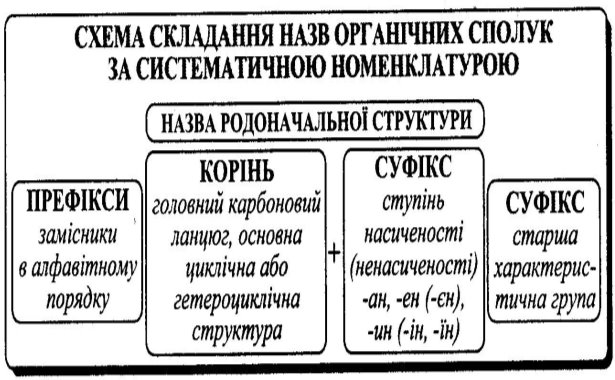
1. В основі назви лежить родоначальна структура (головний ланцюг аліфатичної сполуки, карбо- або гетероциклічна система);
2. Атоми Карбону родоначальної структури нумерують, при цьому нумерацію починають так, щоб атом Карбону, який сполучений із замісником одержав найменший номер);
3. Функціональні групи та замісники позначають префіксами та суфіксами. Суфіксами у назві вказують кратні зв’язки (подвійні, потрійні) та головну функціональну групу;
4. Функціональні групи розташовують за старшинством: –СООН, –СООR, ‑COH, >C=O, –OH, –NH2 (групи перелічені в порядку зменшення старшинства).
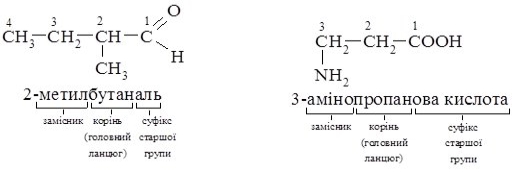
ІV. Систематична номенклатура. Номенклатура ІЮПАК – сучасна номенклатура органічних сполук, що рекомендована комісією Міжнародної спілки чистої та прикладної хімії – ІЮПАК (IUPAC). Її основи закладені на міжнародному конгресі хіміків у Женеві ще у 1892 р. (Женевська номенклатура). У 1930 р. її вдосконалено та доповнено на конгресі хіміків у м. Льєжі (Льєжська номенклатура), і нарешті прийнято на конгресах ІЮПАК у 1957 р. та 1965 р.
Схема складання назв органічних сполук за систематичною номенклатурою наведена у додатку (Додаток 1)
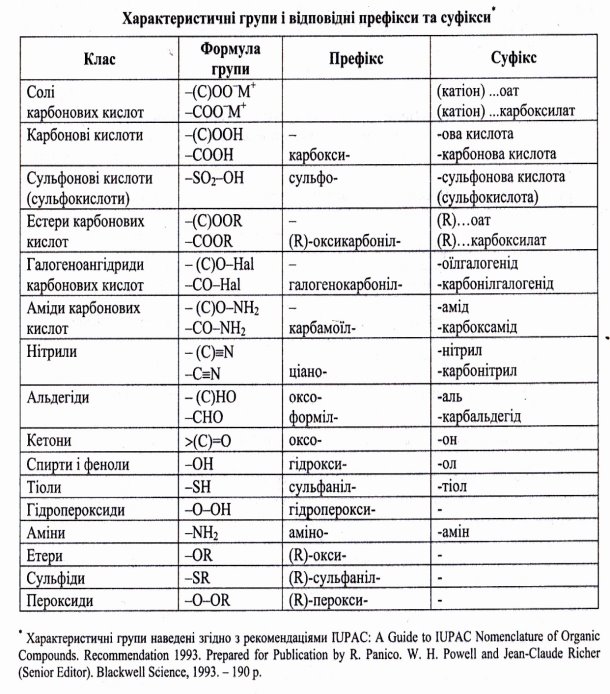
2.3 Характеристичні групи, відповідні префікси та суфікси
Характеристичні групи, відповідні префікси та суфікси в порядку зменшення старшинства наведені у додатку (Додаток 2)
2.4 Ізомерія
Це явище існування молекул з однаковими брутто – формулами, але з різною будовою або різноманітним розташуванням атомів у просторі.
![]()
![]()
![]()
![]() Структурна ізомерія
Структурна ізомерія
Ізомерія карбонового скелету таутомерія міжкласова
Ізомерія розташування (положення замісників, зв’язків)
Просторова ізомерія

 (стереоізомерія)
(стереоізомерія)
Геометрична (цис – транс - ізомерія) оптична ізомерія
- Наявність «=» звязку - асиметричний (хіральний) атом С
- Аліциклічні сполуки
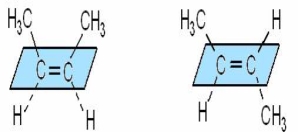
Цис–бут-2-ен транс–бут-2-ен (+) молочна кислота (-)молочна кислота
Оптичні ізомери ще також називають оптичними антиподами або енантіомерами. Енантіомери мають однакові хімічні властивості й відрізняються лише реакційною здатністю відносно оптично активних реагентів.
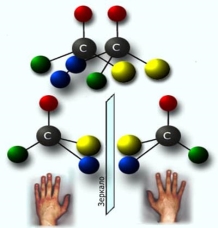 Правий і лівий стереоізомери дзеркально подібні між собою, але не сумісні, як не можна сумістити праву і ліву руку, тому такі молекули називають ще хіральними (від грецьк. “хірос” - рука) або енантіомерами (від грецьк. “енантіос” протилежний).
Правий і лівий стереоізомери дзеркально подібні між собою, але не сумісні, як не можна сумістити праву і ліву руку, тому такі молекули називають ще хіральними (від грецьк. “хірос” - рука) або енантіомерами (від грецьк. “енантіос” протилежний).
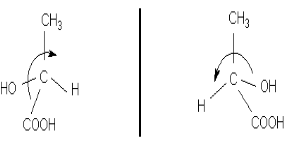
Е.Фішер запропонував для зручності та простоти зображати стереоізомери не у вигляді малюнків, а проекційними формулами. При проектуванні тетраедричної молекули на площину одержують проекційну формулу у вигляді двох ліній, які перетинаються під прямим кутом. У точці перетину знаходиться атом С*, на кінцях горизонтальної ліній – ліганди, що розташовані попереду атома С*, а на кінцях вертикальної лінії – ті, що позаду:

(-)-молочна кислота (+)-молочна кислота
У стереохімії розрізняють поняття абсолютної конфігурації, тобто дійсного розміщення лігандів в оптично активному стереоізомерії, і відносної конфігурації, в якій розміщення лігандів порівнюють із стандартним. За стандарт було взято (+)-гліцериновий альдегід, якому довільно була приписана конфігурація D – гідроксил розміщено з правого боку. Відповідно, ліво обертаючий гліцериновий альдегід позначили буквою L.
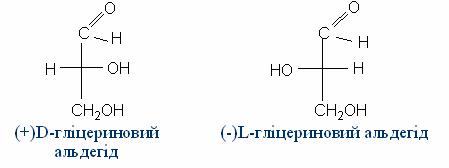
Оптично активні речовини, що були добуті з (+)D-гліцеринового альдегіду, були віднесені до D-ряду незалежно від знаку обертання площини поляризації світла. Тому лівообертаюча (-)-молочна кислота належить до D-ряду:

2.5 Хімічні реакції органічних сполук
- Реакції заміщення (S)
- Реакції приєднання (А)
- Реакції елімінування або відщеплення (Е)
- Перегрупування
За механізмом протікання (із врахуванням способу розриву звязків в реагенті):
- Радикальні (відбувається гомолітичний розрив звязку в реагенті з утворенням вільних радикалів):
X : Y → X∙+Y∙
Реагент вільні радикали
Вільні радикали – це атом чи група атомів, що мають неспарені електрони, але не мають електричного заряду
- Йонні (відбувається гетеролітичний розрив звязків у реагенті з утворенням йонів – електрофілів чи нуклеофілів):
X : Y → X+ +: Y-
Електрофіл (Е) Нуклеофіл (Nu)
В залежності від виду часток (Е чи Nu), що приймають участь у реакції, йонні механізми поділяються на електрофільні чи нулеофільні , наприклад: SR, SE, SNu, AR, AE , ANu
Електрофіл – частинка, що здатна взаємодіяти з електронною парою (навіть мати вільну орбіталь):
А) яка має позитивний заряд (Н+, NO2+);
Б) нейтральні молекули з електронодефіцитним центром (S в SO3, S в SOCL2)
Нуклеофіл – частинка, яка є донором електронної пари по відношенню до будь – якого елемента, крім Гідрогену, зазвичай – до позитивно зарядженого атому Карбону:
А) негативно заряджені йони (ОН-, RO-, CN-);
Б) нейтральні молекули, в яких один атом має неподілену пару електронів – центр з надлишковою електронною густиною (НОН, R – ОH , :NH3, R –О –R)
2.6 Завдання для корекції знань
І. Завдання пошукового характеру:
- Дати назви сполукам за систематичною номенклатурою:
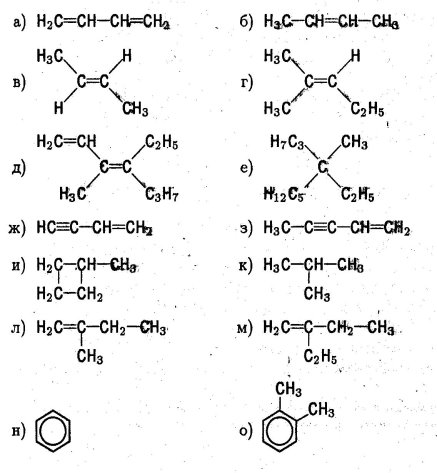
- Скласти схему класифікації органічних речовин по:
а) будові карбонового ланцюга;
б) природі характеристичних груп.
- Назвати сполуку за систематичною номенклатурою:
![]() Н3С – НС = С – СН2 - СН3
Н3С – НС = С – СН2 - СН3
СН3
- Написати структурні формули:
а) 2,3 – диметилпентана;
б) 2–метил - 3–ізопропілгексана.
- Дати визначення явищу ізомерії
- Скласти схему різновидів структурної та просторової ізомерії (з прикладами)
- Написати реакції хлорування:
- метану, пропану;
- Написати рівняння реакцій гідрогенізації та бромування пропену. Яке значення мають ці реакції?
- Продуктом розщеплення глікогену у м’язах при інтенсивній м’язовій роботі є молочна кислота:

Дайте назву за систематичною номенклатурою. Які функціональні групи вона має?
- При пропусканні газоподібного пропілену через водний розчин сульфатної кислоти утворюється спирт. Напишіть рівняння реакції. Поясніть роль сульфатної кислоти. Назвіть продукт. Сформулюйте правило Марковнікова.
ІІ. Завдання у тестовій формі:
-
Який механізм взаємодії етану з хлором?
- Вільнорадикальний.
- Електрофільне заміщення.
- Нуклеофільне заміщення.
- Електрофільне приєднання
- Нуклеофільне приєднання
- Яка з даних формул відповідає формулі парафінів?
- С5Н12
- С5Н10
- С4Н8
- С5Н8
- Яка з наведених формул відображає структуру молекули алкенів?
- С 6Н6
- С 2Н6
- С3Н8
- С4Н8
- С5Н1
- Яка з наведених формул є формулою арену?
- С6Н6
- С3Н6
- С4Н10
- С5Н10
- С5Н12
- З якою з перелічених речовин метан вступає до хімічної реакції:
- З розчином основи
- З розчином сульфатної кислоти
- З розчином калій перманганату
- З хлором
- З розчином фосфатної кислоти
- До якого типу реакцій відноситься взаємодія етану з хлором?
- Приєднання
- Заміщення
- Окиснення
- Відновлення
- Перегрупування
2.7 Словник до розділу ІІ
Асиметричний атом – наявність в молекулі органічної речовини такого атому, який сполучений зі всіма різними атомами чи групами атомі

Геометрична ізомерія – різне розташування у просторі однакових атомів або груп атомів відносно подвійного зв’язку або аліциклічності
Конфігурація молекул – реальне розташування атомів в молекулі
Конформація – це фіксоване розташування атомів чи груп атомів відносно один одного у просторі
Оптична ізомерія – різне просторове розташування замісників біля асиметричних атомів Карбону
Спряження – перерозподіл електронної густини в системі π –зв’язків, що призводить до стабілізації молекули
Стереохімія – галузь хімії, що вивчає просторове розташування атомів і груп атомів у молекулі
Правило Гюккеля (Хюккеля) - правило, згідно якому сполука вважається ароматичною, коли має плаский замкнений цикл, єдину спряжену систему, має 4n +2 π- електронів
Хіральність – неможливість суміщення в одній площині оптичних антиподів
ІІІ. Карбонові кислоти. Ліпіди
Номенклатура карбонових кислот наведена у додатку (Додаток 3)
3.1 Функціональні похідні карбонових кислот
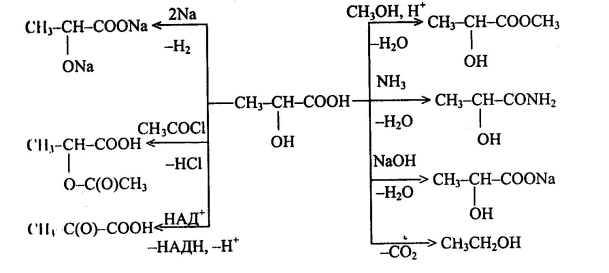
Гідроксикислоти – похідні карбонових кислот, які містять у вуглеводневому заміснику одну або декілька гідроксильних груп
Для гідроксикислот характерна ізомерія структурна та просторова (стереоізомерія).
Найбільш розповсюджені представники природних гідроксикислот:

молочна кислота
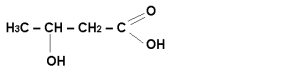
β–гідроксимасляна кислота

![]() -гідроксимасляна кислота (ГОМК)
-гідроксимасляна кислота (ГОМК)
Хімічні властивості гідроксикислот наведені у додатку (Додаток 4).
![]() -Гідроксимасляна кислота НО – СН2 –СН2- СН2- СООН (ГОМК) має наркотичну дію. Застосовується як неінгаляційна наркотична речовина при операціях, нетоксична.
-Гідроксимасляна кислота НО – СН2 –СН2- СН2- СООН (ГОМК) має наркотичну дію. Застосовується як неінгаляційна наркотична речовина при операціях, нетоксична.
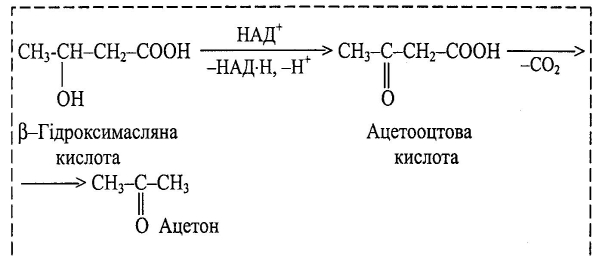
β–Гідроксимасляна кислота утворюється в організмі людини внаслідок β–окиснення жирних кислот і накопичується в організмі. Є попередником ацетооцтової кислоти (3–оксобутанової), яка при хворобі «цукровий діабет» утворює ацетон. Разом їх називають ацетоновими тілами (або кетонові тіла).
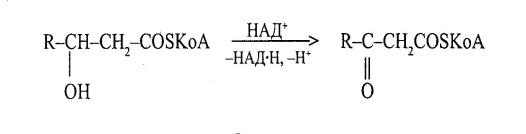
Важливою стадією у метаболізмі жирних кислот є окиснення β – гідроксикислот у вигляді похідних коферменту А у відповідні β – оксикислоти за участю коферменту НАД+
Оксокислоти – це гетерофункціональні сполуки, які містять одночасно карбоксильну і оксо – (альдегідну або кетонну) групи.
Гомологічний ряд альдегідокислот починається з гліоксилової, або гліоксалевої, кислоти
![]()
![]()
![]() О
О
Н – С – СООН
Першою в гомологічному ряду кетокислот є піровиноградна кислота:
![]()
![]() О
О
СН3 – С – СООН
Вона бере участь у циклі трикарбонових кислот. Виділена при піролізі виноградної кислоти. Її солі мають назву піруватів.
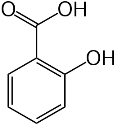
Фенолокислоти – похідні ароматичних кислот, в яких атом Гідрогену у бензольному кільці заміщено гідроксилом.
Найпростішим представником є саліцилова (ортооксибензойна) кислота та її похідні, що мають усі властивості карбонових кислот та фенолу: метилсаліцилат, ацетилсаліцилова кислота, фенілсаліцилат (салол), що використовуються у медицині.
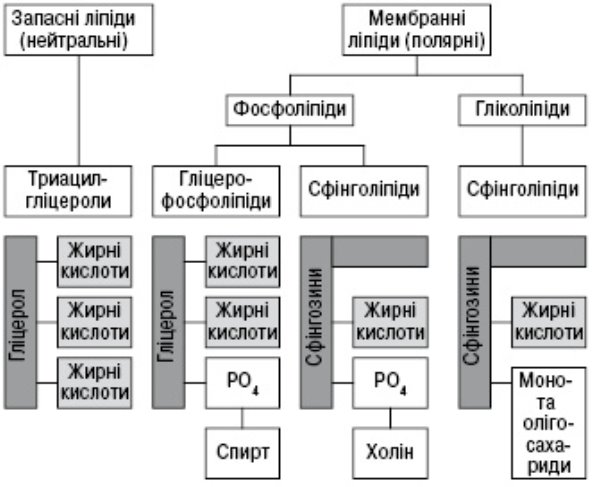
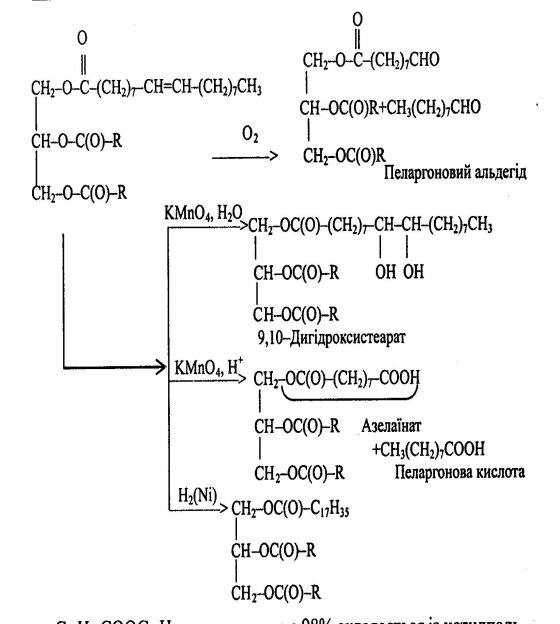
3.2 Ліпіди

 Ліпіди
Ліпіди
Омилювані Неомилювані
(прості – жири, віск; (ізопреноїди, простагландини)
складні – фосфоліпіди, гліколіпіди)
Класифікація ліпідів наведена у додатку (Додаток 5)
Загальна формула:
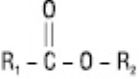
де R1, R2 — алкільний або алкенільний радикали
Тригліцериди:
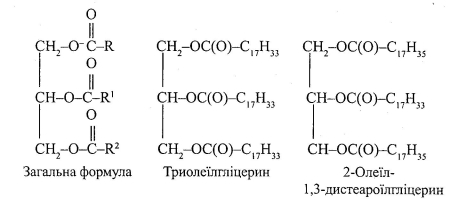
Хімічні властивості тригліцеридів наведені у додатку (Додаток 6):
3.3 Завдання для корекції знань
І.Завдання пошукового характеру:
- Склад речовини визначається формулою С4 Н8 О2. Її водний розчин має кислу реакцію, але при взаємодії з натрій гідроксидом отримується сіль та вода. Напишіть структурну формулу даної речовини
- Які продукти реакції отримуються при нагріванні оксалатної кислоти? Молочної кислоти?
- Які молекули називають хіральними? Як визначається конфігурація хірального (асиметричного) атому Карбону?
-
Написати проекційні формули енантіомерів:
- гліцеринового альдегіду;
- молочної кислоти
- Записати проекційні формули оптичних ізомерів винної кислоти й визначити їх приналежність до D- та L- ряду. Які з цих ізомерів є енантіомерами, а які – діастереомерами? Визначення діастереомерів.
- Яке явище називають таутомерією? Наведіть приклади
- Які сполуки називають кетоновими тілами? Напишіть їх структурні формули. При яких порушеннях обміну речовин в організмі проводиться визначення кетонових тіл?
- Якими хімічними реакціями можна виявити кетонові тіла у біологічних рідинах?
- Напишіть схеми реакцій отримання функціональних похідних саліцилової кислоти:
а) натрій саліцилату;
б) метилсаліцилату;
в) фенілсаліцилату;
г) ацетилсаліцилової кислоти
Яке застосування мають ці речовини у медицині?
- Як класифікують ВЖК? (вищі карбонові кислоти). Наведіть приклади. Яке значення мають ВЖК для організму людини?
- Дайте визначення ліпідам. Наведіть їх класифікацію.
- Напишіть реакцію отримання 1 – ліноленоїл – 2 – олеїноїл – 3 – стеароїлгліцериду. Визначте консистенцію отриманого жиру.
- Як перетворити рідкий ліпід на твердий? Написати рівняння рекції, назвати продукти
- Що утворюється при гідролізі нейтральних ліпідів в кислому та лужному середовищі? Написати відповідні рівняння реакцій, назвати продукти реакції
- Важливу роль в організмі людини відіграє арахідонова кислота С19Н31СООН. Вона є попередником простагландинів - сильнодіючих біорегуляторів. Виходячи з її будови, зробіть висновок – рідиною чи твердим тілом є арахідонова кислота.
- Враховуючи, що у складі триацилгліцеридів оливкової олії переважають залишки олеїнової кислоти, а у складі соняшникової олії – лінолевої, вкажіть, яка олія в більшій мірі підлягає окисненню при тривалому зберіганні?
- Кефаліни й лецитини – незамінні компоненти нервових клітин. Вони разом з деякими білками утворюють білково – ліпідні комплекси – ліпопротеїди, які являють собою компоненти клітинних мембран. Фосфатидами багаті печінка, серцевий м’яз, еритроцити. Вони присутні в таких продуктах, як яєчний жовток, соєві боби, ікра. Їх нестача породжує недокрів’я, захворювання нервової системи. Як вони утворюються? Напишіть рівняння реакцій.
ІІ. Завдання у тестовій формі:
- Яка з перелічених карбонових кислот найчастіше зустрічається у складі твердих жирів?
- етанова
- пропіонова
- капронова
- стеаринова
-
метанова
- До складу рослинних олій входять переважно залишки ненасичених карбонових кислот. Вкажіть таку кислоту:
- С17Н35СООН
- С15Н31СООН
- С17Н33СООН
- С19Н39СООН
-
С13Н27СООН
- Вкажіть кислоту, у складі молекули якої містить два подвійних зв’язки:
- стеаринова
- олеїнова
- лінолева
- ліноленова
-
пальмітинова
- До складу жиру людини входить біля 70 % залишків олеїнової кислоти. Вкажіть її формулу:
- С17Н35СООН
- С15Н31СООН
- С17Н33СООН
- С19Н39СООН
-
С13Н27СООН
- Вкажіть триацилгліцерид, який може знебарвити бромну воду:
- 1,2,3 – тристеарат гліцерину
- 1,2,3 – трипальмітат гліцерину
- 1,2 – дипальмітат – 3 – олеїноат гліцерину
- 1,2 – дипальмітат – 3 – стеарат гліцерину
-
1,2 – дистеарат – 3 – пальмітат гліцерину
- Вкажіть тригліцерид, який не вступає до реакції гідрогенізації:
- 1,2,3 – трипальмітат гліцерину
- 1,2,3 – триолеїнат гліцерину
- 1,2 – дипальмітат – 3 – олеїноат гліцерину
- 1 – ліноленат – 2- олеїноат – 3 – стеарат гліцерину
- 1,2 – дистеарат – 3 –олеїноат гліцерину
3.4 Словник до розділу ІІІ
Аміноспирти – сполуки, що містять в молекулі одночасно і гідроксильну, і аміногрупу
Аміди кислот – функціональні похідні карбонових кислот, в яких гідроксильна група заміщена на аміногрупу
Ароматичні кислоти – кислоти, в яких карбоксильна група безпосередньо повязана з ароматичним кільцем
Аспірин – ацетилсаліцилова кислота
Винний камінь – кисла калійна сіль винної кислоти
Воски (цериди) – це прості ліпіди, естери вищих карбонових кислот й високомолекулярних спиртів (цетилового – С16Н33ОН й мірицилового - С30Н61ОН)
ВЖК (вищі жирні кислоти) або вищі карбонові кислоти – представники монокарбонових кислот, що мають у своїй будові парну кількість (більш ніж 10) атомів Карбону в молекулах нерозгалудженої будови
Гліколіпіди – сполуки, в яких ліпідна частина (гліцерол або сфінгозин, ВЖК) ковалентно з’єднана з вуглеводневим компонентом (глюкозою, галактозою)
Ди-, три-, полікарбонові кислоти - кислоти, що мають відповідно дві, три та більше груп - СООН
Енантіомери – дві асиметричні молекули, які мають однакову молекулярну формулу, але різну просторову будову (дзеркальні антиподи) і не можуть бути суміщені в одній площині усіма атомами і групами атомів
Карбонові кислоти – похідні вуглеводнів, що мають у своєму складі функціональну (характеристичну) карбоксильну групу – СООН
Лактиди, лактони – складні оксигеновмісні гетероцикли, які утворюються при реакціях дегідратації гідроксикислот
Мила – солі вищих жирних кислот
Монокарбонові кислоти – мають у своєму складі одну карбоксильну групу –СООН
Оксикислоти (гідроксикислоти) – похідні карбонових кислот, які мають у своєму складі поряд з карбоксильною групою й окси – (гідроксильну) групу
Оксокислоти (кетокислоти) – похідні карбонових кислот, які у своєму складі поряд з карбоксильною групою мають й карбонільну (кето-) групу
Рацемат – рівномолекулярна суміш двох енантіомерів
Салол – феніловий естер саліцилової кислоти
Сегнетова сіль – середня змішана калійно – натрієва сіль винної кислоти
Стероїди – біоорганічні сполуки тваринного походження – естери циклічних спиртів – стеролів й жирних кислот, утворюються в природі з ізопреноїдних попередників
Сфінгофосфоліпіди – естери багатоатомного аміноспирту сфінгозину й ВЖК, які містять залишки фосфатної кислоти й аміноспиртів
Триацилгліцерини (нейтральні ліпіди) – естери гліцерола й трьох молекул жирних кислот
Фенолокислоти – похідні ароматичних кислот, в яких атом Гідрогену у бензольному ядрі заміщено гідроксилом
Фосфоліпіди (фосфатиди), гліцерофосфоліпіди - складні ліпіди, які у своєму складі мають залишки гліцеролу, ВЖК й фосфатної кислоти, естерифікованої аміноспиртами й серином.
ІV. Амінокислоти. Білки
Загальна формула амінокислот:
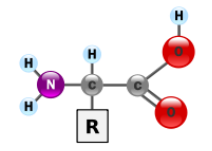
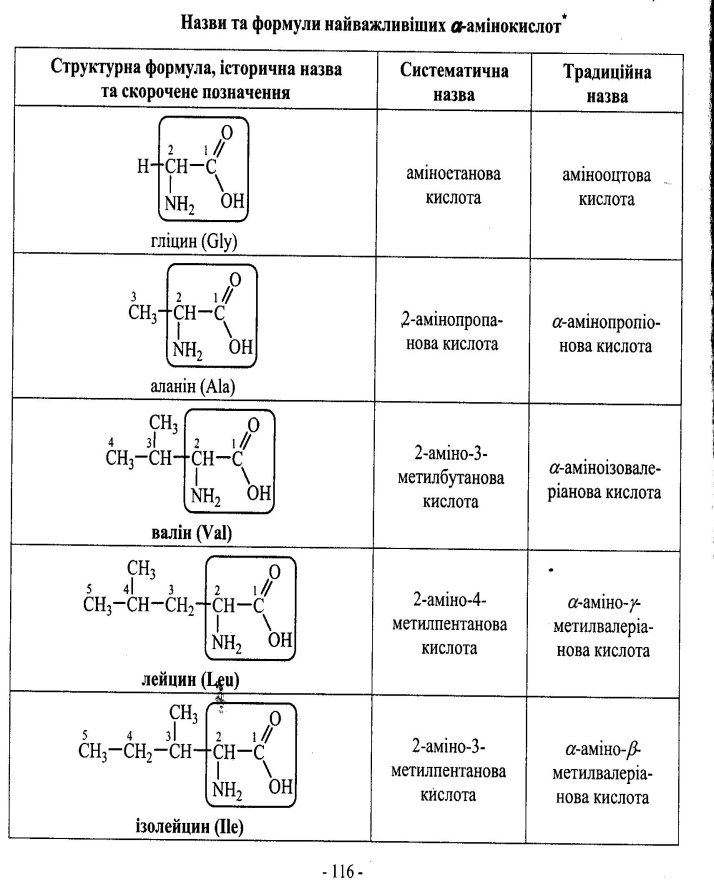
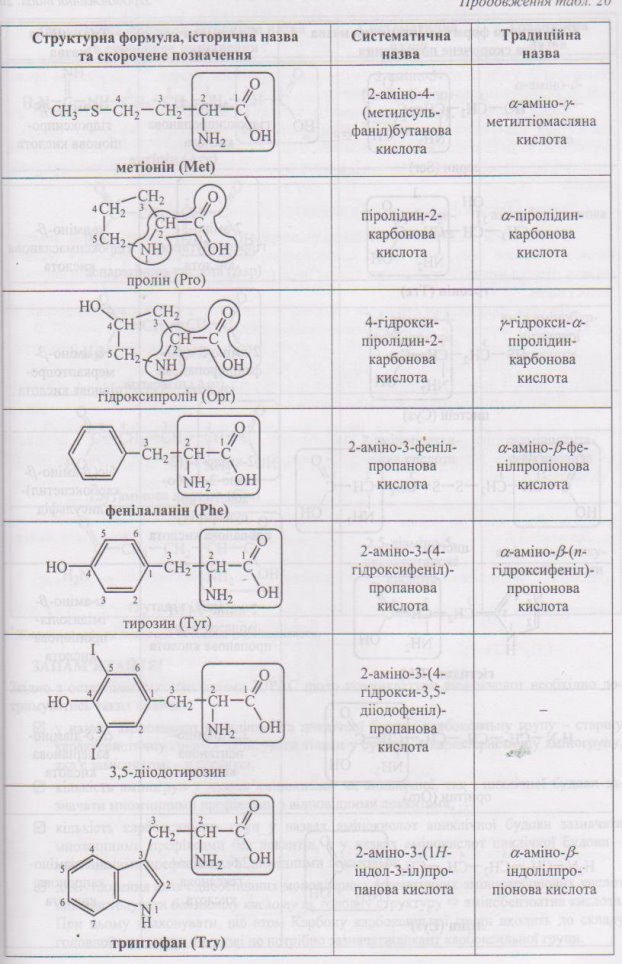
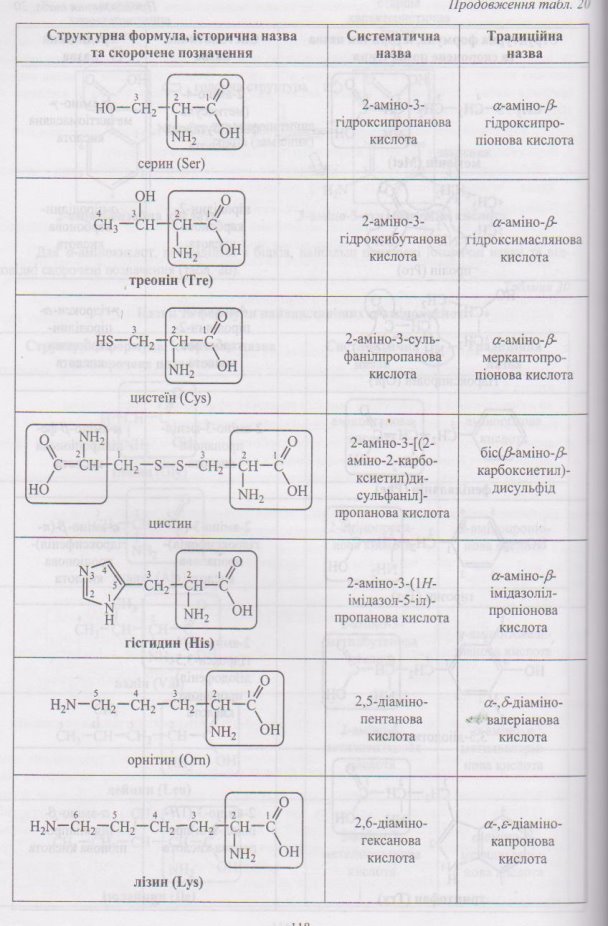
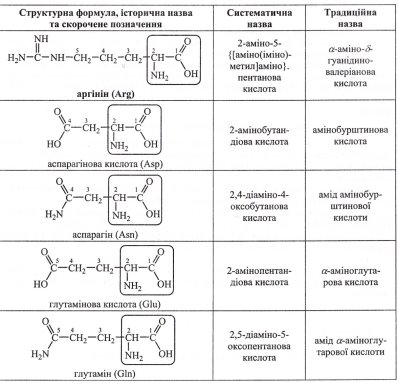
4.1 Номенклатура амінокислот.
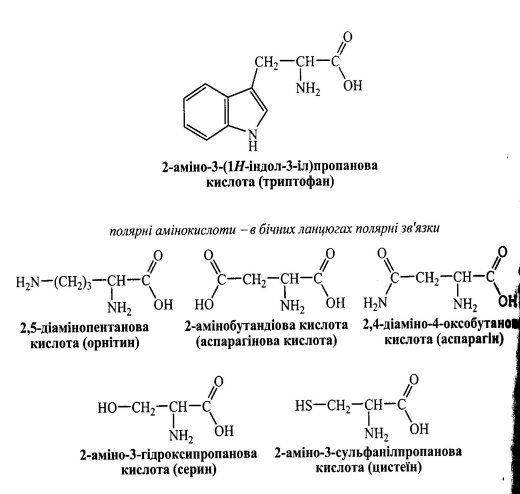
Номенклатура амінокислот наведена у додатку (Додаток 7)
У водному розчині α - амінокислоти існують у вигляді рівноважної суміші, яка складається з катіонної, аніонної форм та цвіт тер –йона:

4.2 Хімічні властивості амінокислот:
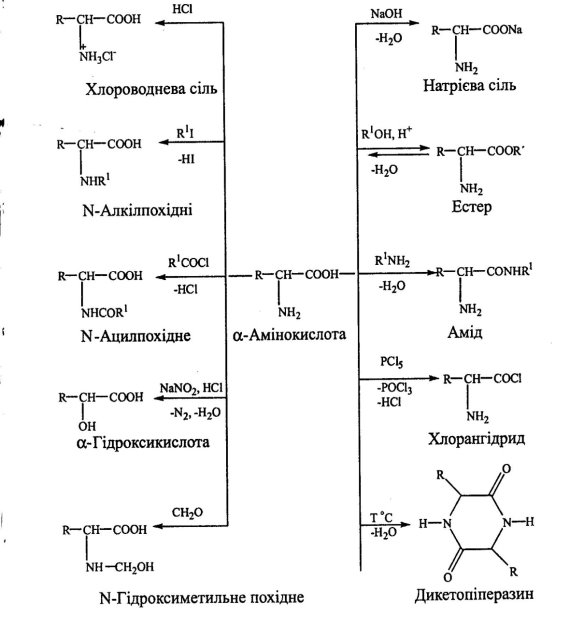
Хімічні властивості амінокислот наведені у додатку (Додаток 8)
4.3 Завдання для корекції знань:
І. Завдання пошукового характеру:
- За якими принципами класифікують амінокислоти?
- Як визначити належність амінокислоти до D- чи L- стереохімічного ряду?
- Які саме стереоізомери амінокислот входять до складу білків?
- Напишіть проекційні формули стереоізомерів: а) аланіну; б) ізолейцину
- Напишіть рівняння реакції дезамінування метіоніну
- Запишіть рівняння реакції декарбоксилування триптофану та гістидину. Назвіть продукти. Яку біологічну роль вони виконують?
- Які реакції використовують для якісного визначення амінокислот?
- Таутомерні форми пептидного зв’язку
- Запишіть схему якісної реакції на пептидний зв'язок.
- Серотонін – гормон, утворений з амінокислоти триптофану внаслідок її окисного декарбоксилування. Цей гормон відноситься до фізіологічно активних сполук, регулює процеси збудження й гальмування в ЦНС, грає роль у розвитку шизофренії. При невеликому підвищенні його концентрації настає стан ейфорії, що проявляється в руховій активності, сміху без причини, багатослів’ї та ін.. При зниженні концентрації серотоніну настає стан депресії (відмова від їжі, спілкування, нерухомість). Напишіть реакції окисного і неокисного декарбоксилування триптофану. Назвіть отримані продукти.
- Кортикотропін (адренокортикотропний гормон АКТГ) є гормоном пептидної природи, що складається з залишків 39 амінокислот. Знаючи, що пептиди – це поліаміди, які мають амідні зв’язки, поясніть, з чим пов'язаний той факт, що прийом всередину кортикотропіну не ефективний? Чи буде ефективним прийом всередину гормону білкової природи інсуліну при цукровому діабеті?
- Колаген – один з найпоширеніших білків людського організму. На його частку припадає до 30% від загальної кількості білку. Колаген являє собою волокнистий нерозчинний у воді білок. Разом з іншими компонентами він утворює колагенові волокна, які складають основну масу сполучної тканини організму. Яка структура цього білка і які зв’язки у ній?
- У всіх тваринних тканинах і в деяких рослинах широко розповсюджений низькомолекулярний трипептид глутатіон. Одна з головних його функцій– збереження ферментів в активній відновній формі при окисно – відновних реакціях. Глутатіон являє собою атиповий трипептид наступної будови: γ – глутамінілцистеїнілгліцин. Знаючи формули амінокислот, напишіть його структуру
- Які пептиди – гормони отримані синтетичним шляхом? Яка їх структура та біологічна роль?
- Широке застосування, особливо у харчовій промисловості. У якості цукрозамінника отримав штучний (генно-інженерний синтез) дипептид, що складається з L – ізомерів аспарагінової кислоти й метилового естеру фенілаланіну, який названо аспартамом. Аспартам у сотні разів солодший за цукор і легко розпадається в організмі на дві вільні амінокислоти. Напишіть реакцію синтезу аспартаму.
- Складні білки містять два компоненти – простий білок і небілкову речовину (простетичну групу), яка міцно пов’язана з білковою молекулою. Чим відрізняються складні білки між собою? Які їх фізико – хімічні властивості?
ІІ. Завдання у тестовій формі:
-
Які ізомери амінокислот є протеїногенними?
- α
- β
- γ
- δ
- ε
-
До якого стереохімічного ряду відносяться амінокислоти, що входять до складу білків організму людини?
- D
- L
- P
- S
-
Вкажіть назву амінокислоти, розчин якої має нейтральну реакцію середовища:
- лізин
- аспартат
- гліцин
- глутамат
- аргінін
-
Вкажіть назву амінокислоти, розчин якої змінює забарвлення фенолфталеїну:
- лізин
- аспартат
- гліцин
- глутамат
- аспарагін
-
Вкажіть назву амінокислоти, розчин якої змінює забарвлення синього лакмусу:
- лізин
- аспартат
- гліцин
- валін
- ізолейцин
-
Яка сполука виділиться при декарбоксилуванні α – амінокислот?
- СО2
- NH3
- Н2О
- Н2S
- НСІ
-
Які зв’язки формують первинну структуру білкових молекул?
- водневі
- пептидні
- йонні
- гідрофобні
- металічний
-
Які зв’язки формують вторинну структуру білкових молекул?
- водневі
- пептидні
- йонні
- гідрофобні
- естерні
-
Який тип зв’язку не приймає участі у формуванні третинної структури білка?
- водневі
- пептидні
- йонні
- дисульфідні
- естерні
-
Вторинна структура білка – це:
- конформація поліпептидного ланцюга
- об’єднання протомерів
- олігомірний білок
- два поліпептидних ланцюга у вигляді α – спіралі
- послідовність амінокислотних залишків
-
У результаті утворення оксигемоглобіну з гемоглобіну кисень приєднується до:
- піррольного кільця
- глобіну
- метилової групи між двома піррольними кільцями
- йону Ферруму у складі гему
- мембрани еритроциту
12. Більшість білків здатні утворювати:
- істинні розчини
- сольові розчини
- нейтральні розчини
- коллоїдні розчини
- тверді розчини
4.4 Словник до розділу ІV:
Амінокислоти (АК) – гетерофункціональні біоорганічні речовини, які містять одночасно аміно - та карбоксильну групи
Амфотерність амінокислот – прояв одночасно кислотних властивостей (за карбоксильною группою) та основних (за аміногрупою)
Білки – біоорганічні високомолекулярні сполуки, які побудовані із залишків α – L – амінокислот
Біогенні аміни – фізіологічно активні речовини (гормони, нейромедіатори), які мають аміногрупу
Вторинна структура білка- певна конформація поліпептидного ланцюга у трьохвимірному просторі
α– спіраль – це конформація, яка утворюється при просторовому скручуванні поліпептидного ланцюга у вигляді спіралі за рахунок водневих зв’язків, що виникають між пептидними групами поліпептидного ланцюга
β – структура - структура складчастого шару, що утворюється з кількох зигзагоподібних згорнутих поліпептидних ланцюгів, розташованих поряд
Висолювання високомолекулярних сполук — процес виділення в осад розчиненої ВМС шляхом додавання електролітів. В. обумовлене зниженням розчинності ВМС при введенні електролітів.
ГАМК – гама – аміномасляна кислота, гальмуючий медіатор ЦНС
Глобулярні білки – білки, що мають округлу форму (кулеподібну чи еліпсоподібну) , згорнуті у щільну структуру
Глутатіон – трипептид, що складається з АК: γ – Глу – Цис –Глі та приймає участь в ряді окисно – відновних процесів у живих організмах
Декарбоксилування – реакція виділення вуглекислого газу при розщепленні α – карбоксильної групи амінокислот
Дезамінування - реакція відщеплення аміногрупи у вигляді молекули амоніаку
Денатурація – втрата нативної, властивої білку, просторової структури
Доменні білки – білкові молекули, окремі ділянки поліпептидного ланцюга яких можуть утворювати глобулярні структури (домени)
Ізоелектрична точка – значення рН розчину, за яким сумарний заряд молекули АК дорівнює нулю
Ізоелектричний стан молекули білка – це стан білкової молекули, при якому загальний електричний заряд її дорівнює нулю і вона не рухається в електричному полі
Ксантопротеїнова реакція – якісна реакція на ароматичні амінокислоти
Зв'язок між двома α-амінокислотними залишками зазвичай називається пептидного зв'язком, а полімери, побудовані із залишків α-амінокислот, сполучених пептидними зв'язками, називають поліпептидами.
N – кінець – кінець пептиду, що несе вільну аміногрупу першої амінокислоти
Незамінні амінокислоти – не синтезуються в організмі людини, потрапляють разом із їжею.
Осадження білків – випадіння білка з колоїдного розчину в осад.
Основи Шиффа -заміщені іміни, які утворюються при взаємодії α – АК з альдегідами
ПАЛФ, ПАМФ – коферменти амінотрансфераз: піридоксальфосфат, піридоксамінфосфат – похідні вітаміну В6
Пептиди – біомолекули, що відрізняються від білків меншими розмірами і молекулярною масою, а також фізико – хімічними властивостями
Первинна структура білка – певна послідовність амінокислотних залишків у поліпептидному ланцюгу від N – кінця до С – кінця
Прості білки – білки, що складаються лише з залишків амінокислот
Реакція Серенсена (формолтитрування) - реакція, яка дає можливість визначити точну кількість α – амінокислот у вихідному розчині за кількістю лугу, що витрачено на титрування карбоксильних груп
Реакція Ван – Слайка – реакція, що дає можливість визначити концентрацію α – амінокислот у вихідному розчині зо об’ємом газоподібного азоту, що виділився при взаємодії з нітритною кислотою (НNО2)
Реакція Міллона – специфічна реакція на тирозин
Реакція Фоля – якісна реакція на сульфуровмісні амінокислоти
С – кінець – кінець пептиду, що несе карбоксильну групу останньої амінокислоти
Складні білки – клас білків, які є комплексом білкової та небілкової частини
Таутомерія – це тип ізомерії, при якій відбувається швидке оборотне самовільне взаємоперетворення структурних ізомерів - таутомерів.
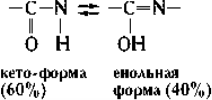
Трансамінування - реакція міжмолекулярного переносу аміногрупи з α –амінокислоти на α – кетокислоту з утворенням нової кетокислоти й нової амінокислоти
Третинна структура – спосіб упакування в трьохвимірному просторі поліпептидного ланцюга з певною вторинною структурою
Четвертинна структура білків – комплекс з кількох субодиниць в третинній (глобулярній) структурі
Фібрилярні білки – білки, структурною особливістю яких є витягнута форма молекул
V. Вуглеводи
Вуглеводи — органічні сполуки з емпіричною формулою Cm(H2O)n
5.1 Класифікація вуглеводів
- За типом карбонільної групи
Альдози (містять альдегідну групу)
Кетози (містять кетонну групу)
- За кількістю С-атомів
Триози (3 С)
Тетрози (4 С)
Пентози (5 С)
Гексози (6 С)
Вищі цукри (> 6 С)
- За типом карбонільної групи та за кількістю С-атомів
Альдопентози (-СНО + 5С)
Альдогексози (-СНО + 6С)
Кетопентози (або пентулози) (-СRО + 5С)
Кетогексози (-СRО + 6С)
- За функціональними групами
Нейтральні (>С=О + -ОН)
Кислі (>С=О + -ОН + СООН)
Аміноцукри (>С=О + -ОН + NH2)
Дезоксицукри (>С=О + -Н (замість-ОН))
Аномери – діастереомери, що розрізняються між собою лише конфігурацією при аномерному, або напівацетальному, атомі вуглецю.
Аномери мають різні температури плавлення та величини питомого обертання ( t пл., []20D ).
Для -форми характерне розташування глікозидного гідроксилу в проекції Фішера з того самого боку відносно циклічного ланцюга, що і гідроксил, який визначає конфігурацію моносахариду в цілому (D- або L-). -Форма реалізується при розміщенні даних гідроксилів по різні боки відносно циклічного ланцюга.
- -


-D-Глюкопіраноза D-Глюкоза -D-Глюкопіраноза
5.2 Завдання для корекції знань
І. Завдання пошукового характеру:
- У яких формах (циклічних, ациклічних) перебувають моносахариди у твердому стані та у розчині?
- Які докази можна навести на користь існування циклічних форм моносахаридів?
- Як довести існування ациклічних форм моносахаридів?
- Які існують докази взаємного перетворення різних форм моносахаридів? У яких умовах відбуваються ці перетворення?
- Якщо з метил-α-L-арабінозидом або метил-β-D-ксилозидом провести реакції метилювання, гідролізу та окиснення азотною кислотою, то утворюється триметоксиглутарова кислота. Який розмір циклу був у цих альдопентозидів? Які сполуки утворюються при окисненні кожного з цих альдопетозидів під дією HIO4?
- Глюкоза реагує з оцтовим ангідридом, утворюючи двіпентаацетильних похідні, жодна з них не відновлює реактив Фелінга або Толленса. Поясніть ці факти.
- За яким принципом поділяють на групи дисахариди?
- Назвати тип зв’язку в молекулах дисахаридів: а) мальтози, б) лактози, в) сахарози
- Записати формулами Хеуорса цикло – оксо – таутомерні форми: а) мальтози, б) лактози, в) целобіози
- Чи будуть мутарутувати водні розчини мальтози, лактози, сахарози і чому?
- Написати рівняння реакції кислотного гідролізу сахарози і назвати продукти реакції
- Запишіть схему гідролізу крохмалю і назвіть проміжні та кінцеві продукти
- Напишіть схему будови глікогену та вкажіть відмінності від крохмалю
- Яке біологічне значення мають глікозаміноглікани? Напишіть біозний фрагмент хондроїтин – 4- сульфата
ІІ. Завдання у тестовій формі:
- При гідролізі сахарози утворюється:
- Глюкоза і глюкоза
- Глюкоза і галактоза
- Глюкоза і манноза
- Фруктоза і глюкоза
- рибоза і фруктоза
- При гідролізі мальтози утворюється:
- Фруктоза і фруктоза
- Глюкоза і галактоза
- Глюкоза і манноза
- Фруктоза і глюкоза
- Глюкоза і глюкоза
- При гідролізі лактози утворюється:
- Фруктоза і фруктоза
- Глюкоза і галактоза
- Глюкоза і манноза
- Фруктоза і галактоза
- Глюкоза і глюкоза
- Які з даних вуглеводів не здатні до реакції гідролізу?
- Мальтоза
- Сахароза
- Фруктоза
- Крохмаль
- Целобіоза
- Який вуглевод відкладається у печінці при надлишковому вживанні глюкози в організмі?
- Крохмаль
- Сахароза
- Мальтоза
- Глікоген
- Амілоза
- Макромолекула крохмалю складається із залишків молекул:
- Нециклічної форми глюкози
- Циклічної α – глюкопіранози
- Глюкози і фруктози
- Циклічної β – глюкопіранози
- Циклічної α – галактопіранози
- Що слугує структурним компонентом глікогену?
- α – D – глюкопіраноза
- α – D – галактопіраноза
- β - D – глюкопіраноза
- α – D – глюкофураноза
- β - D – глюкофураноза
5.3 Словник до розділу V
Глікозидо – глікозидний зв'язок – зв'язок, що виникає при дегідратації між глікозидним гідроксилом одного моносахариди та глікозидним гідроксилом другого моносахариду. Характерний для невідновлюючих дисахаридів
Гомополісахариди – полісахариди (поліглікозиди), що складаються з однакових моносахаридних залишків
Гетерополісахариди – полісахариди, побудовані з великої кількості різних моносахаридних залишків
Епімери – різновид оптичних ізомерів моносахаридів, які відрізняються конфігурацією тільки одного атому Карбону
Енантіомери – два ізомери, що відносяться один до одного як предмет та його дзеркальне відображення – D- та L- стереоізомери
Діастереомери – стереоізомери моносахаридів, що не є дзеркальними зображеннями один одного й відрізняються за хімічними та фізичними властивостями
Інвертний цукор – суміш моносахаридів, що утворюється у результаті гідролізу сахарози
Інверсія – явище зміни напрямку й кута питомого обертання площини поляризованого світла при гідролізі сахарози справа наліво (внаслідок інверсії розчину)
Моносахариди – вуглеводи, які не гідролізують з утворенням більш простих вуглеводів
Мутаротація – зміна кута нахилу площини поляризованого світла при пропусканні його крізь розчин моносахаридів після його стояння (внаслідок утворення рівноважної суміші циклічних та оксо – форм)
Оптична активність- властивість обертати площину поляризованого світла вправо (+) або вліво (-)
Полісахариди - це біополімери, утворені внаслідок конденсації моносахаридів
Складні вуглеводи – вуглеводи, що складаються з двох (дисахариди) та більше (оліго – та полісахариди – більше 10) залишків моносахаридів, які сполучені між собою О – глікозидним зв’язком
Цикло – оксо – таутомерія – здатність моносахаридів до існування у вигляді рівноважної суміші відкритих та циклічних форм таутомерів
VI. Біологічно активні гетероциклічні сполуки. Нуклеотиди, нуклеозиди, нуклеїнові кислоти
6.1 Завдання для корекції знань
- Що таке нуклеїнова кислота, РНК та ДНК? У чому відмінність РНК від ДНК?
- З розділу «Вуглеводи» пригадайте, скільки ізомерних форм рибози може існувати в природі. Зобразіть формули α-D-рибофуранози, β-D-рибофуранози та нециклічної L-рибози.
- Що таке нуклеїнові основи? До якого класу сполук вони належать? Зобразіть формули нуклеїнових основ, залишки яких входять до складу ДНК. Назвіть їх.
- Що таке нуклеозид? нуклеотид? Чим вони відрізняються один від одного? Чим різняться між собою рибонуклеозиди та дезоксирибонуклеозиди?
- Поділіть наведені нижче сполуки на нуклеїнові основи, нуклеозиди, нуклеотиди: тимідин-З'-фосфат, тимідин, тимін, уридин, урацил, уридин-5'-фосфатаденін, аденозин, дезоксіаденозин-З'-фосфат, дезоксигуанозин, гуанозин-5'-фосфат, гуанозин, гуанін, дезоксицитидин-З'-фосфат, цитидин-5'-фосфат, цитидин, цитозин. Які з наведених нуклеозидів та нуклеотидів входять до складу ДНК, а які — до складу РНК? Напишіть скорочені назви наведених сполук.
- Зобразіть формули сполук, перелічених у завданні 5.
- Зобразіть формули олігонуклеотидів та назвіть нуклеозиди, які входять до їх складу: рGрСрА, рdCрТрdА, GрUрСр, dТрdАрdGр.
6.2 Словник до розділу VI
Азоли – ароматичні гетероциклічні п’ятичленні сполуки з двома гетеро атомами
Ароматичні гетероциклічні сполуки – сполуки, що відповідають критеріям ароматичності: містять єдину спряжену систему, мають плоский скелет й кількість π – електронів, що відповідає правилу Хюккеля
Гетероциклічні сполуки – сполуки циклічної будови, які містять у циклі, крім атомів Карбону, й інші атоми (сульфуру, оксисену, нітрогену)
Нуклеотид – трикомпонентна біоорганічна молекула, що складається із залишків азотистої (нітратної, нуклеїнової) основи, пентози (рибози чи дезоксирибози) та фосфатної кислоти
Нуклеозид - двокомпонентна біоорганічна молекула, що складається із залишків азотистої (нітратної, нуклеїнової) основи та пентози (рибози чи дезоксирибози)
ПАЛФ – коферментна форма вітаміну В6 – піридоксальфосфат
ПАМФ - – коферментна форма вітаміну В6 – піридоксамінфосфат
Правило Хюккеля – ароматичні сполуки – це сполуки з циклічними плоскими молекулами, з єдиною спряженою системою зв’язків, що охоплює усю циклічну молекулу, до складу якої входить кількість електронів, що відповідають формулі N=4n+2, де n – ціле число.
VІI. Лабораторний практикум
Методичні вказівки до практичних завдань містять опис лабораторних експериментів, що ілюструють основні закономірності, розглянуті в теоретичній частині (Додаток 9).
ВИСНОВКИ
Навчання хімії у старшій школі забезпечує формування у випускників наукового світогляду, хімічної культури як складника загальної культури сучасної людини і розвитку їхнього творчого потенціалу задля успішної соціалізації в сучасному суспільстві. Одним із шляхів диференціації та індивідуалізації навчання є впровадження в шкільну практику системи курсів за вибором та факультативів, які реалізуються за рахунок варіативного компонента змісту освіти і доповнюють та поглиблюють зміст навчального предмета. Саме із цією метою автором було укладено програму курсу за вибором «Основи біоорганічної хімії» для 11 класу з поглибленим вивченням хімії та біології та було поставлено за мету дібрати відповідні навчальні матеріали.
Сучасна методика викладання перевагу надає проблемному навчанню. Посилюється увага до інтерактивних методів, виконання навчальних проектів. Змінюються акценти в діяльності вчителя. Учитель виконує роль супроводу, консультує, підтримує активність, створює умови для збільшення самостійності учнів у навчальній діяльності.
Для відповіді на поставлені задачі було на меті створення відповідного навчального посібника, у якому б містилися орієнтовні завдання для конструювання уроків.
У даному навчальному посібнику вміщено завдання для коригування знань учнів у формі тестів, завдань практичного спрямування у формі лабораторних та практичної робіт, а також завдань пошукового характеру, які можуть слугувати орієнтиром у проектній діяльності. Оскільки об’єм посібника регламентовано, теоретичний матеріал подано у вигляді тез та винесено у додатки, а також є перелік використаних джерел, які можуть стати у нагоді під час пошуку відповідей. Така подача матеріалу дозволить вчителю переходити до методик, які дозволяють учням самостійно здобувати знання під час навчальної діяльності.
Матеріал даного посібника було використано на уроках курсу за вибором у 11 класах хіміко-біологічного профілю Ліцею інформаційних технологій Олександрійської міської ради у 2013-2015 роках. Випускники даних класів наразі є студентами медичних, фармацевтичних та хіміко-технологічних ВНЗ.
Використання запропонованого курсу за вибором активізує пізнавальну діяльності учнів на уроках хімії та біології, дає можливість підвищити якість навчання, сформувати стійкий інтерес учнів до хімії, про що свідчать результати ЗНО, підвищення результативності участі учнів у ІІ та ІІІ етапах Всеукраїнської учнівської олімпіади з хімії та біології.
Використані джерела:
- Бобрівник Л.Д. та ін. Органічна хімія: Підруч. для студ. вищ. навч. закл./ Л. Д. Бобрівник, В.М. Руденко, Г.О. Лезенко. – К.; Ірпінь: ВТФ «Перун», 2005. – 544с.
- Всеукраїнська електронна бібліотека [Електронний ресурс].– Режим доступу: http://youalib.com/
- Лист МОН від 20.08.2018 № 1/9-503 “Про переліки навчальної літератури, рекомендованої Міністерством освіти і науки України для використання у закладах загальної середньої освіти” [Електронний ресурс].– Режим доступу: https://imzo.gov.ua/2018/08/22/
- Миронович Л.М. Біоорганічна хімія: Скорочений курс: Навч. посібн. 2-ге вид. – К.: Каравела, 2010. – 184 с.
- Пивоваренко В.Г. Основи біоорганічної хімії: Підручн. для 11 кл серед. загальноосв. шк. з поглибл. вивч хімії. – 2-ге вид., перероб. і допов. – К.: Освіта, 1998. – 176 с.
- Програма з хімії для 10-11 класів загальноосвітніх навчальних закладів (поглиблене вивчення) [Електронний ресурс].– Режим доступу: https://mon.gov.ua/ua/osvita/zagalna-serednya-osvita/navchalni-programi/
- Толмачова В.С., Ковтун О.М., Корнілов М.Ю., Гордієнко О.В., Василенко С.В. Сучасна термінологія та номенклатура органічних сполук: Навчально-методичний посібник для вчителів та учнів загальноосвітніх навчальних закладів. — Тернопіль: Навчальна книга — Богдан, 2008. — 176 с.
- Биоорганическая химия: учебник для студентов-иностранцев высших медицинских учебных учреждений IV уровня аккредитации / под ред. Ю. И. Губского. - Винница: Нова Книга. 2010.-232 с.
ДОДАТКИ
Хімічні властивості гідроксикислот:
Класифікація ліпідів
Хімічні властивості тригліцеридів
Жирні кислоти, що входять до складу жирів




Хімічні властивості амінокислот
Лабораторна робота №1. Відкриття оксалатної кислоти у вигляді кальцієвої солі
Мета: виявити оксалатну кислоту у вигляді кальцій оксалату
Реактиви: кристали оксалатної кислоти, 1мл дистильованої води, розчин кальцій хлориду
Обладнання: пробірка, піпетка, скляна паличка для перемішування
Хід роботи:
До пробірки поміщаємо кристали оксалатної кислоти, 10 краплин води й перемішуємо до повного розчинення. Додаємо 1 краплину розчину кальцій хлориду.
Опишіть свої спостереження. Зробіть висновки. Поясніть результат
Лабораторна робота №2. Утворення розчинного мила
Мета: довести властивість вищих карбонових кислот утворювати із лугами розчинні у воді солі
Реактиви: розчин олеїнової кислоти, розчин натрій гідроксиду
Хід роботи:
До пробірки вміщуємо 10 краплин розчину олеїнової кислоти й 5 краплин розчину натрії гідроксиду. Спостерігаємо за розігріванням вмісту пробірки, що свідчить про протікання реакції нейтралізації. Отримуємо розчин натрій олеату
Опишіть свої спостереження. Зробіть висновки. Поясніть результат
|
Хімічна реакція |
Умови |
Спостереження |
Висновки |
|
|
|
|
|
Лабораторна робота №3. Властивості нейтральних ліпідів
Мета: дослідити деякі властивості нейтральних ліпідів
Реактиви: 1мл олії соняшникової, вода, етер етиловий
Хід роботи:
У пробірку із водою додайте додайте 0,2-0,3 мл олії. Вміст пробірки енергійно струсіть. Що ви спостерігаєте? Поясніть результати. У пробірку із етиловим етером додайте 0,2-0,3 мл олії. Вміст пробірки енергійно струсіть. Що ви спостерігаєте? Поясніть результати. Зробіть висновки.
Лабораторна робота №4. Виготовлення розчину білка
Мета: набути навичок видобувати з деяких біоматеріалів білок
Реактиви: 50 г м’яса, 10% розчин NaCl
Обладнання: фільтрувальний папір, хімічні склянки ємністю 100 мл, конічні колби місткістю 250-300 мл, скляні палички, лійка
Хід роботи:
У склянку помістіть пропущене через м’ясорубку нежирне м'ясо масою 40-50 г і додайте 10% розчин NaCl об’ємом 80-100 мл. Добуту масу перемішайте протягом 15 хв. і відфільтруйте крізь паперовий складчастий фільтр або марлю. У червоному на колір фільтраті містяться переважно альбумін і глобулін.
Опишіть дослід, зробіть висновки.
Лабораторна робота №5. Денатурація і ренатурація білків
Мета: встановити умови, за яких відбувається денатурація і ренатурація білків
Реактиви й обладнання: розчини білків, NaC1 у кристалах, насичений розчин NaСІ, МgS04 у кристалах, 1%-вий та 9-10%-ві розчини оцтової кислоти, 10%-вий розчин NаОН, 5%-вий розчин СuS04, 5%-вий розчин РЬ(СН3СОО)2, 10%-вий розчин таніну, 5%-вий розчин НС1, 40%-вий формалін, насичений розчин фенолу, лійки, фільтри, пробірки.
1. Денатурація та ренатурація білків способом зміни йонної сили розчину та температури. У пробірки налийте 1-1,5 мл розчину білків добутих у попередній роботі, додайте рівний об'єм насиченого розчину (NН4)2S04 і суміш злегка струсіть. З'являється каламуть від глобулінів, що випадають в осад під час денатурації. Каламутну рідину профільтруйте крізь сухий складчастий фільтр. Половину фільтрату нагрійте до кипіння. Спостерігайте денатурацію альбумінів. До іншої частини фільтрату при інтенсивному перемішуванні додайте твердий сульфат амонію (NН4)2S04, доки він не перестане розчинятись. У таких умовах з'являються каламуть або пластівці альбуміну, що денатурував. У пробірки з денатурованими альбуміном та глобуліном додайте дистильованої води й струсіть їх. Завдяки ренатурації білки розчиняються.
2. Денатурація білка нагріванням та зміною рН розчину. У п'ять пробірок налийте пo 2 мл розчину білка. Нагрійте вміст першої пробірки. Осад білка чи помутніння з'являється ще до того, як рідина закипить. У другу пробірку додайте 1 краплю 1% -вого розчину СН3СООН і нагрійте її вміст. Осад білка випадає швидше і повніше. У третю пробірку додайте 0,5 мл розчину 10%-вої СН3СООН і нагрійте її. Осад не утворюється навіть під час кип'ятіння. У четверту пробірку прилийте 0,5 мл розчину 10%-вої СН3СООН та кілька крапель насиченого розчину NаСІ і нагрійте її вміст. Утворюється осад білка. У п'яту пробірку прилийте близько 0,5 мл розчину NаОН і нагрійте її вміст. Осад білка не утворюється навіть під час кип'ятіння.
Денатурація під час нагрівання характерна майже для всіх білків. Найлегше й повніше вона відбувається у слабкокислому середовищі, біля ізоелектричної точки (дослід 2). У нейтральному та кислому середовищах денатурація відбувається гірше (досліди 1 та 3), а в лужному середовищі взагалі ніколи не спостерігається.
3. Денатурація білків за наявності солей важких металів. У дві пробірки налийте по 1-1,5 мл розчину білка й краплями додайте розчини солей: у першу — СuS04, у другу — РЬ(СН3СОО)2. Утворюються осади в кожній із пробірок. За наявності надлишку реактиву осади можуть знову розчинитися.
Солі важких металів (Нg, Аg, Сu, РЬ та ін.) викликають незворотну денатурацію білків і утворюють із ними нерозчинні солі. Внаслідок цього білки (яйця, молока) застосовують як протиотруту під час отруєння солями важких металів.
Опишіть досліди, зробіть висновки
Практична робота. Кольорові реакції на амінокислоти та білки
Реактиви й обладнання: розчини білків, нерозведений білок яйця, концентрована нітратна кислота, 25%-вий розчин NН4ОН, 10%-вий та 30%-вий розчини NаОН, 1%-вий розчин СuS04, 5%-вий розчин гіпохлориту (NаСlO), лакмусовий папір, пробірки.
Кольорові реакції білків зумовлені властивостями певних бокових ланцюгів амінокислот, що складають білок.
Ксантопротеїнова реакція. До 1 мл розчину білка добавте 5-6 крапель концентрованої HNO3 до появи білого осаду або помутніння скоaгульованого білка. Під час нагрівання осад і розчин забарвлюються в яскраво-жовтий колір. Суміш охолодіть і обережно, не струшуючи, додайте до неї краплями концентрований розчин NH4ОН або NаОН до лужної реакції. Осад розчиняється, а розчин забарвлюється в яскраво-оранжевий колір.
Ксантопротеїнову реакцію дають білки, що містять ароматичні амінокислоти: фенілаланін, тирозин, триптофан, які піддаються нітруванню. У лужному середовищі нітрований тирозин дає яскраво забарвлену сіль. Желатин не містить ароматичних кислот і не дає ксантопротеїнової реакції
Біуретова реакція. До 1-2 мл розчину білка приливають такий же об'єм лугу, потім — 2-3 краплі розведеного розчину СuS04. Розчин забарвлюється в червоно-фіолетовий колір. Біуретова реакція — результат утворення комплексної сполуки Купруму за пептидними групами білка. Її дають усі білки. Амінокислоти не дають біуретової реакції.
Опишіть досліди, зробіть висновки.
Лабораторна робота №6. Якісні реакції на виявлення моносахаридів
Мета: навчитися виявляти за допомогою якісних реакцій на характеристичні групи деякі моносахариди
Обладнання та реактиви: 1% водний розчин глюкози, 5 мл аміачного розчину арґентум (І) оксиду, вода, 10% розчин NaOH, 2% розчин CuSO4, пробірки, водяна баня
Хід роботи:
Реакція срібного дзеркала.
В пробірку з 5 мл аміачного розчину арґентум(І) оксиду додають декілька кристаликів досліджуваної сполуки, суміш обережно нагрівають на водяній бані при 60-70 С впродовж 2-3 хв. Відновлюючі вуглеводи виявляють за утворенням срібного дзеркала на стінках пробірки. Окисненню піддіється лише ланцюгова форма вуглеводу:
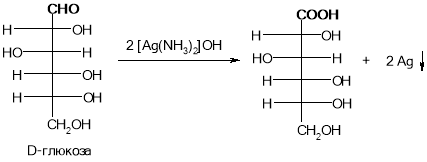
Цю реакцію дають всі альдегіди та деякі інші споріднені сполуки (наприклад, похідні альдегідів - альдіміни).
Доказ наявності гідроксильних груп у складі глюкози
У пробірку вміщуємо 10 краплин розчину глюкози, 6 краплин розчину NaOH та 3 краплини розчину CuSO4. Утворюється осад Cu(OH)2, який швидко розчиняється
Проба Троммера (виявлення відновлюючих цукрів).
Відновлення гідроксиду купруму (ІІ) глюкозою в лужному розчині.
До отриманого в попередньому досліді прозорого розчину купрум (ІІ) сахарату синього кольору додають кілька крапель води так, щоб висота рідини в пробірці була 20 мм.
Пробірку тримають похило і обережно нагрівають у полум’ї пальника верхню частину розчину. Спостерігається перехід синього забарвлення розчину в зелене, а потім його знебарвлення.
Одночасно з’являється жовтий осад оксиду купруму (І) (у розчині може існувати гідратована форма Cu2OxH2O), що агрегуючись перетворюється в червоно-коричневий осад оксиду купруму (І):

Альдонові кислоти у розчинах існують переважно в циклічній формі -лактону:

Лабораторна робота №7. Якісна реакція на крохмаль
Мета: виявити наявність крохмалю йодною пробою
Обладнання та реактиви: картопляний чи кукурудзяний крохмаль, розчин йоду в КІ, пробірки, піпетки
Хід роботи:
У пробірку вміщуємо 10 краплин розчину крохмалю та 1 краплину розчину йоду. Спостерігаємо зміну забарвлення.
1


про публікацію авторської розробки
Додати розробку