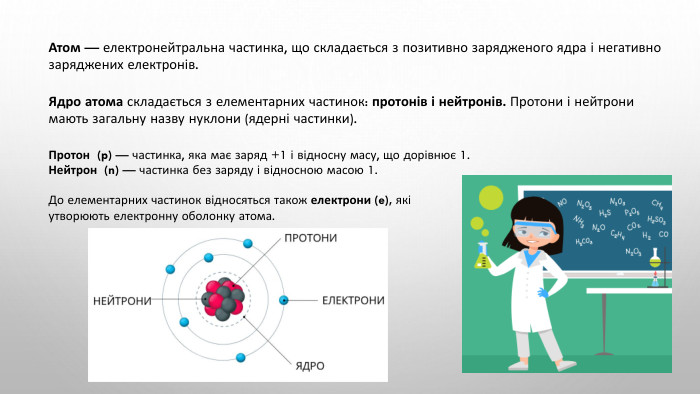
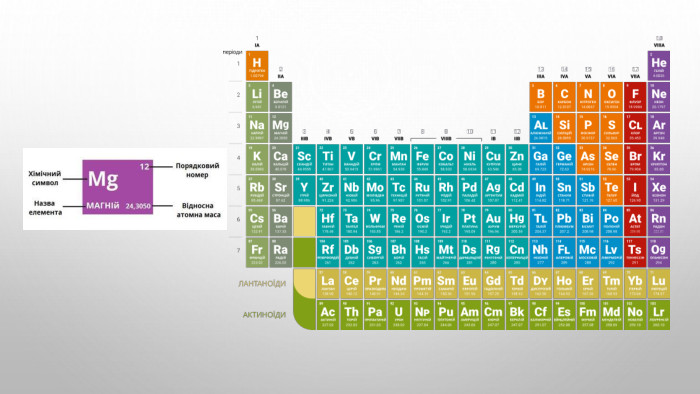
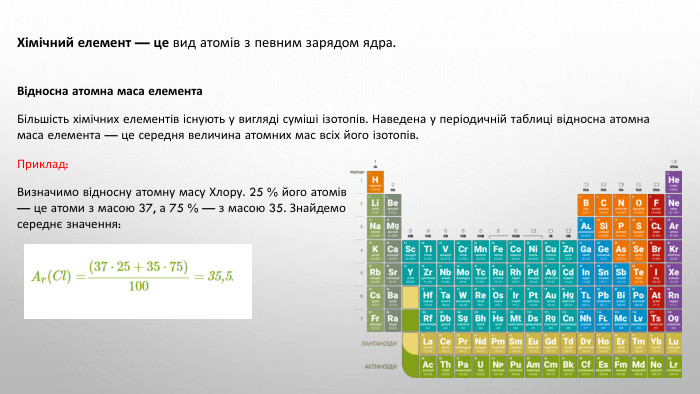
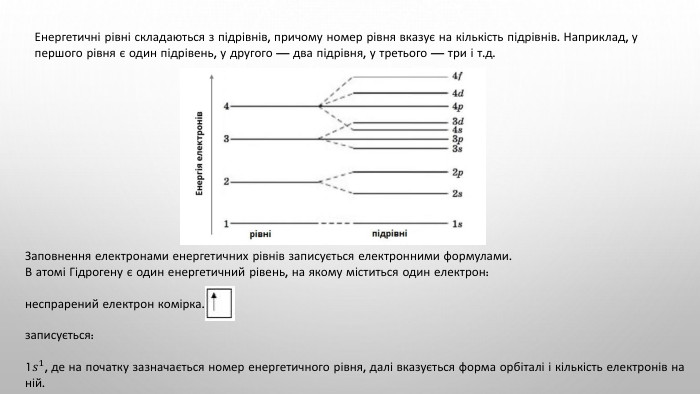
Підготовка доо НМТ 2025 Хімія (Протонне число)
Про матеріал
Хі́мія або хе́мія — одна з наук про природу, яка вивчає молекулярно-атомні перетворення речовин, тобто, при яких молекули одних речовин руйнуються, а на їхньому місці утворюються молекули інших речовин з новими властивостями. Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку