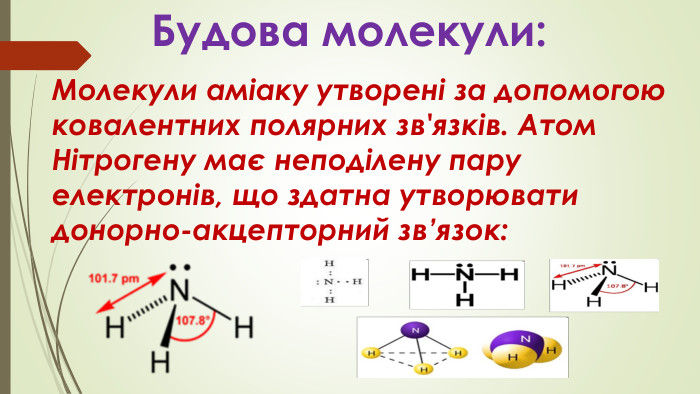
Презентація " Амоніак: фізичні та хімічні властивості, застосування."
Про матеріал
Презентація для використання під час вивчення нового матеріалу за темою "Амоніак". Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку