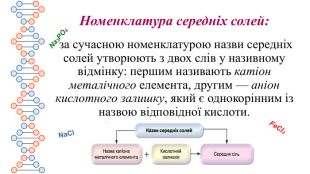
Солі. Середні та кислі солі
Про матеріал
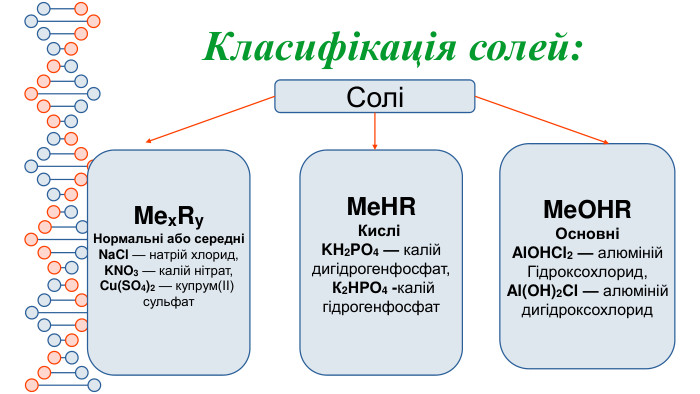
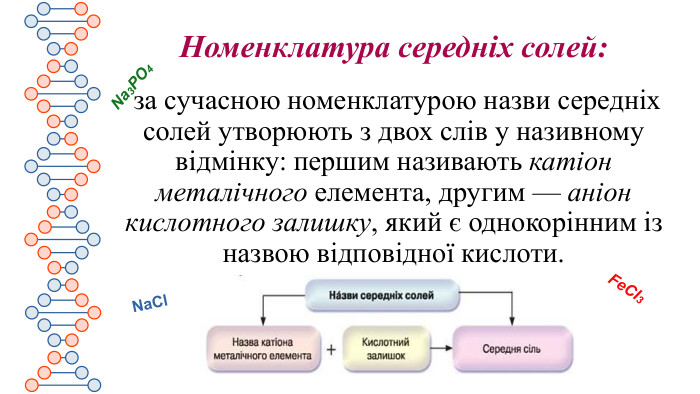
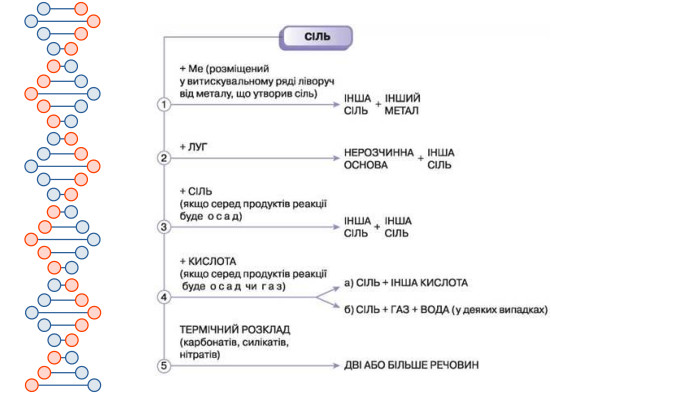
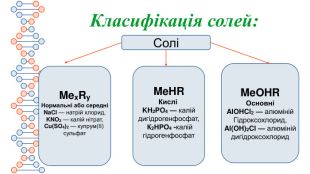
Презентація містить інформацію про середні та кислі солі. Їх фізичні та хімічні властивості Перегляд файлу
Зміст слайдів


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку