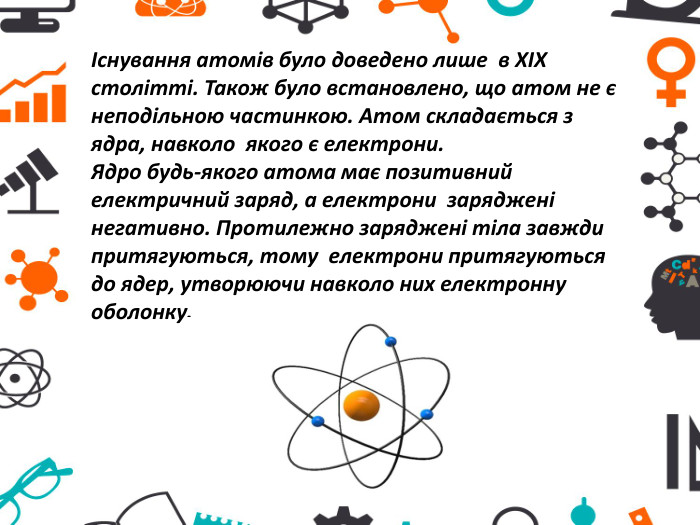
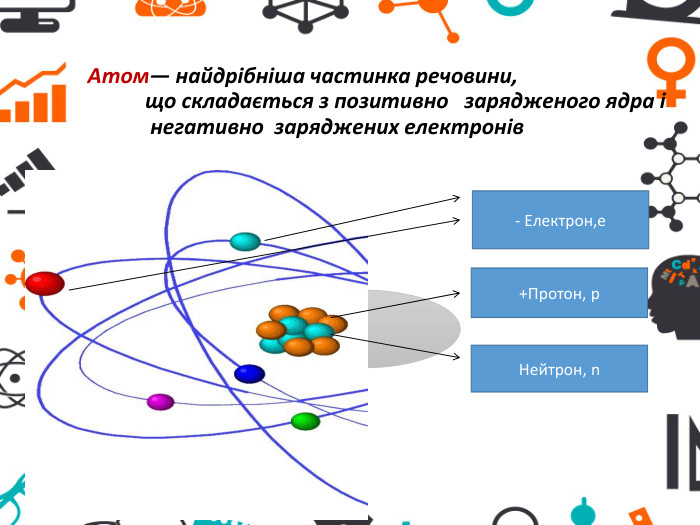
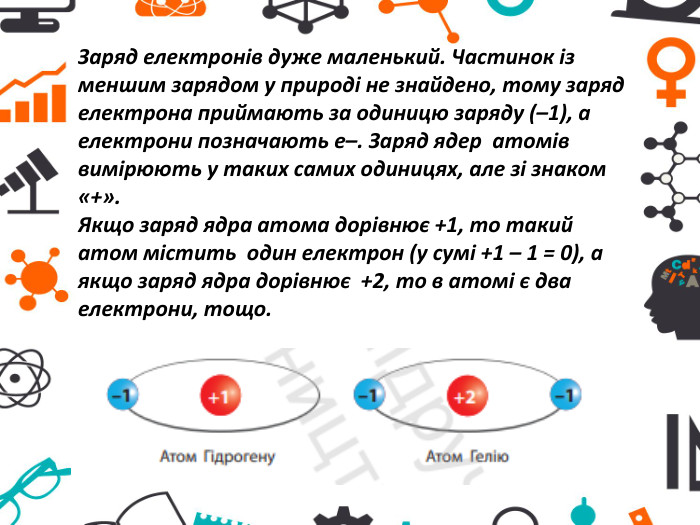
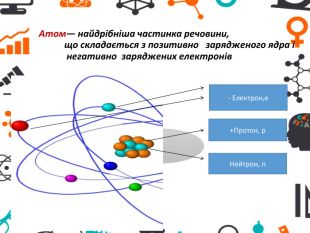
Презентація "Атоми та хімічні елементи"
Про матеріал
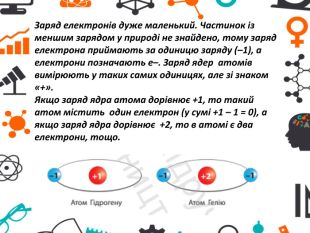
Презентація може бути використана на уроках хімії (7 клас НУШ) під час вивчення теми "Атоми та хімічні елементи" (розділ "Від хімічних елементів до хімічних сполук"). Перегляд файлу
Зміст слайдів
Середня оцінка розробки
Оцінки та відгуки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку