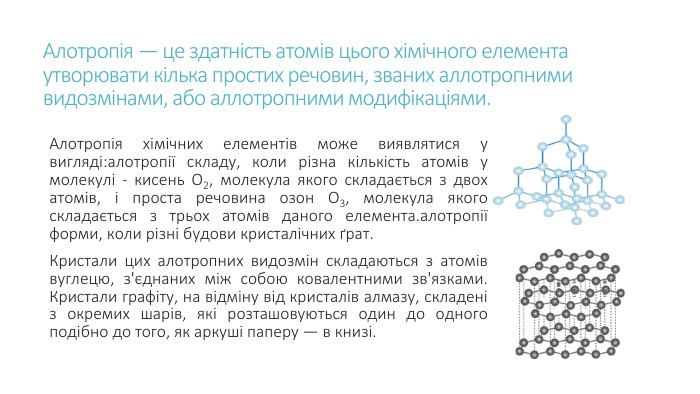
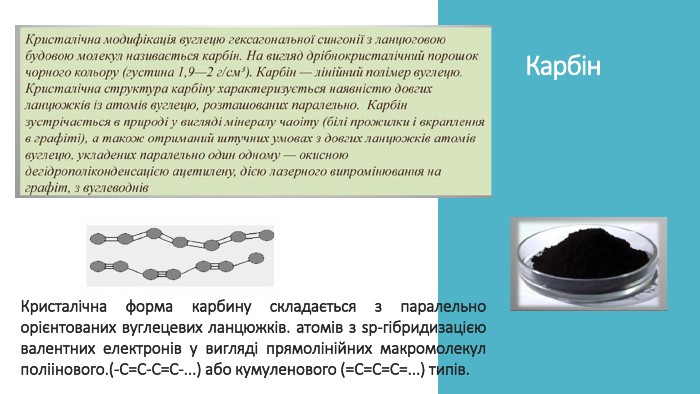
Презентація до уроку на тему "Явище алотропії"
Про матеріал
У темі "Неметалеві елементи" треба приділити особливу увагу явищу алотропії, алотропним модифікаціям Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки


Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку