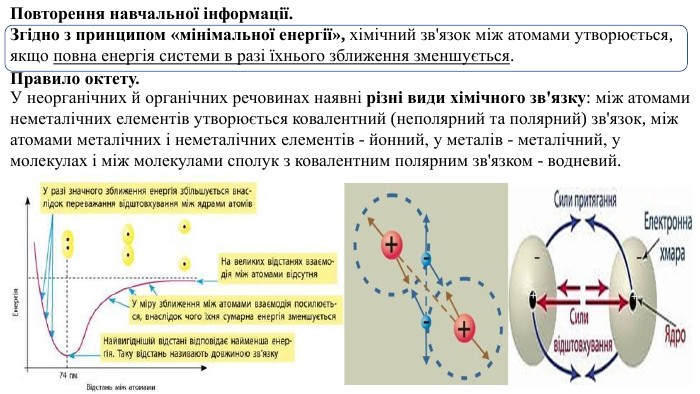
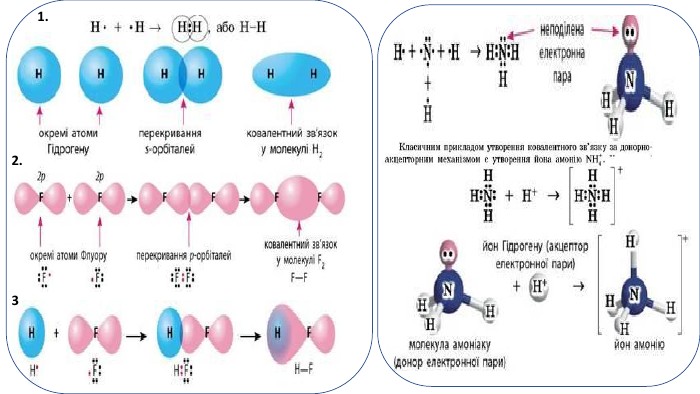
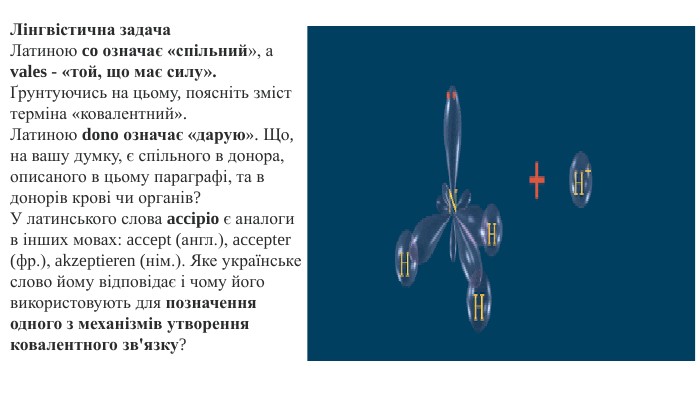
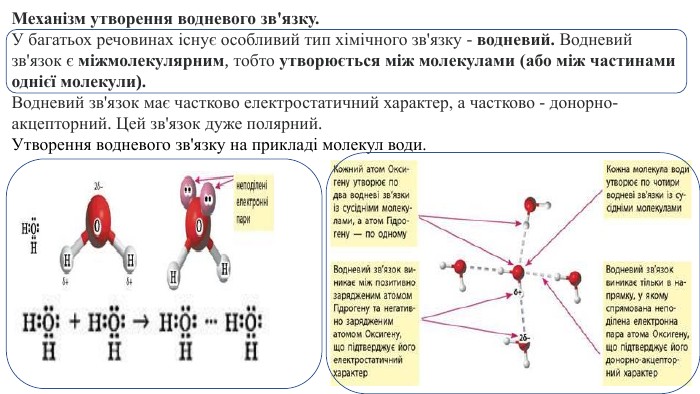
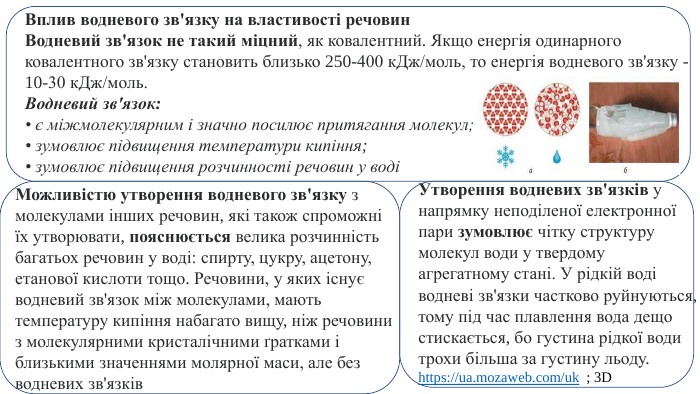
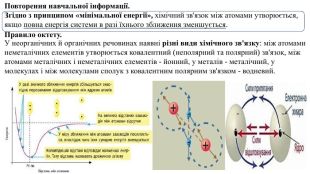
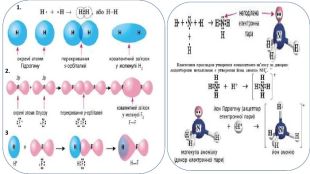
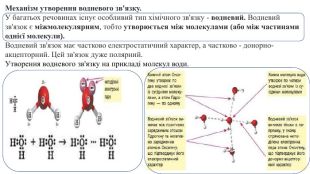
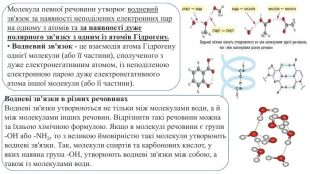
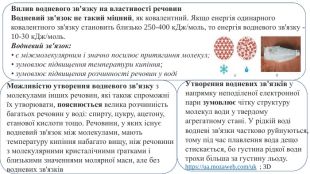
Презентація. "Ковалентний хімічний зв’язок. Водневий хімічний зв’язок."
Про матеріал
Пропоную до уваги добірку навчального матеріала у вигляді презентації. Презентація за темою "Ковалентний хімічний зв’язок. Водневий хімічний зв’язок." може бути корисною та використана під час підготовки до уроку або під час уроку онлайн або офлайн заняття. Перегляд файлу
Зміст слайдів
pptx
Оцінка розробки

Безкоштовний сертифікат
про публікацію авторської розробки
про публікацію авторської розробки
Щоб отримати, додайте розробку
Додати розробку